Electrón
| Electrón e− | ||
|---|---|---|
 La naturaleza de partícula del electrón se demostró por primera vez con un tubo de Crookes. En esta ilustración, un haz de electrones proyecta el perfil en forma de cruz del objetivo contra la cara del tubo.[1] | ||
| Clasificación | Partículas elementales[2] | |
| Familia | Fermión | |
| Grupo | Leptón | |
| Generación | Primera | |
| Interacción | Gravedad, Electromagnetismo, Nuclear débil | |
| Antipartícula | Positrón | |
| Teorizada | Richard Laming (1838-1851),[3] G. Johnstone Stoney (1874) y otros.[4][5] | |
| Descubierta | J. J. Thomson (1897)[6] | |
| Masa | 9,109 382 91(40)×10−31kg[7] 5,485 799 094 6(22)×10−4uma[8] 0,510998928(11) MeV/c2 [9] 1822.8884845 (14)−1 u[nota 1] | |
| Carga eléctrica | −1 e −1.602 176 565(35)×10−19C[10][nota 2] | |
| Momento magnético | −1.00115965218111 μB[11] | |
| Carga de color | - | |
| Espín | ± 1/2 | |
[editar datos en Wikidata] | ||
En física, el electrón (del griego clásico ἤλεκτρον ḗlektron 'ámbar'), comúnmente representado por el símbolo e−, es una partícula subatómica con una carga eléctrica elemental negativa.[12] Un electrón no tiene componentes o subestructura conocidos; en otras palabras, generalmente se define como una partícula elemental. En la teoría de cuerdas se dice que un electrón se encuentra formado por una subestructura (cuerdas).[2] Tiene una masa que es aproximadamente 1836 veces menor que la del protón.[13] El momento angular (espín) intrínseco del electrón es un valor semientero en unidades de ħ, lo que significa que es un fermión. Su antipartícula es denominada positrón: es idéntica excepto por el hecho de que tiene cargas —entre ellas, la eléctrica— de signo opuesto. Cuando un electrón colisiona con un positrón, las dos partículas pueden resultar totalmente aniquiladas y producir fotones de rayos gamma.
Los electrones, que pertenecen a la primera generación de la familia de partículas de los leptones,[14] participan en las interacciones fundamentales, tales como la gravedad, el electromagnetismo y la fuerza nuclear débil.[15] Como toda la materia, poseen propiedades mecánico-cuánticas tanto de partículas como de ondas, de tal manera que pueden colisionar con otras partículas y pueden ser difractadas como la luz. Esta dualidad se demuestra de una mejor manera en experimentos con electrones a causa de su ínfima masa. Como los electrones son fermiones, dos de ellos no pueden ocupar el mismo estado cuántico, según el principio de exclusión de Pauli.[14]
El concepto de una cantidad indivisible de carga eléctrica fue teorizado para explicar las propiedades químicas de los átomos. El primero en trabajarlo fue el filósofo naturalista británico Richard Laming en 1838.[4] El nombre electrón para esta carga fue introducido en 1894 por el físico irlandés George Johnstone Stoney. Sin embargo, el electrón no fue identificado como una partícula hasta 1897 por Joseph John Thomson y su equipo de físicos británicos.[6][16][17]
En muchos fenómenos físicos —tales como la electricidad, el magnetismo o la conductividad térmica— los electrones tienen un papel esencial. Un electrón en movimiento genera un campo electromagnético y es a su vez desviado por los campos electromagnéticos externos. Cuando se acelera un electrón, puede absorber o radiar energía en forma de fotones. Los electrones, junto con núcleos atómicos formados de protones y neutrones, conforman los átomos. Sin embargo, los electrones contribuyen con menos de un 0,06 % a la masa total de los átomos. La misma fuerza de Coulomb, que causa la atracción entre protones y electrones, también hace que los electrones queden enlazados. El intercambio o compartición de electrones entre dos o más átomos es la causa principal del enlace químico.[18] Los electrones pueden ser creados mediante la desintegración beta de isótopos radiactivos y en colisiones de alta energía como, por ejemplo, la entrada de un rayo cósmico en la atmósfera. Por otra parte, pueden ser destruidos por aniquilación con positrones, y pueden ser absorbidos durante la nucleosíntesis estelar. Existen instrumentos de laboratorio capaces de contener y observar electrones individuales, así como plasma de electrones. Además, algunos telescopios pueden detectar plasma de electrones en el espacio exterior. Los electrones tienen muchas aplicaciones, entre ellas la electrónica, la soldadura, los tubos de rayos catódicos, los microscopios electrónicos, la radioterapia, los láseres, los detectores de ionización gaseosa y los aceleradores de partículas.
Índice
1 Historia
1.1 Descubrimiento
1.2 Teoría atómica
1.3 Mecánica cuántica
1.4 Aceleradores de partículas
1.5 Confinamiento de electrones individuales
2 Características
2.1 Clasificación
2.2 Propiedades fundamentales
2.3 Propiedades cuánticas
2.4 Partículas virtuales
2.5 Interacción
2.6 Átomos y moléculas
2.7 Conductividad
2.8 Movimiento y energía
3 Formación
4 Observación
5 Aplicaciones del plasma
5.1 Haces de partículas
5.2 Creación de imágenes
5.3 Otras aplicaciones
6 Véase también
7 Fuentes
7.1 Notas
7.2 Referencias
8 Enlaces externos
Historia
Véase también: Historia de la electricidad
Los antiguos griegos se percataron que el ámbar atraía pequeños objetos cuando se le frotaba contra el pelaje. Junto con el rayo, este fenómeno es una de las primeras experiencias conocidas de los humanos con la electricidad.[19] En su tratado de 1600 De Magnete, el científico inglés William Gilbert definió el término neolatino «electricus» para referirse a la propiedad de un objeto de atraer otros pequeños después de ser frotado.[20] Tanto las palabras eléctrico como electricidad derivan del latín «electrum», que a su vez proviene de la palabra griega «ήλεκτρον» («elektron»), que significa ámbar.
A principios de los años 1700, Francis Hauksbee y Charles François de Cisternay du Fay descubrieron, cada uno por su lado, lo que creían que eran dos tipos de electricidad friccional: uno generado por el rozamiento con vidrio, y el otro por el rozamiento con resina. A partir de esto, Du Fay teorizó que la electricidad consistía en dos fluidos eléctricos, el «vítreo» y el «resinoso», que estaban separados por la fricción y que se neutralizaban el uno al otro cuando eran combinados.[21] Una década más tarde, Benjamin Franklin propuso que la electricidad no provenía de dos tipos diferentes de fluido eléctrico sino de un mismo fluido a presiones diferentes; les dio la nomenclatura moderna de carga «positiva» y «negativa», respectivamente.[22] Franklin pensaba que el portador de carga era positivo, pero no identificó correctamente qué situación reflejaba un excedente del portador de carga y en qué caso era un déficit.[23]
Entre 1838 y 1851, el filósofo naturalista británico Richard Laming desarrolló la idea de que un átomo estaba compuesto de un núcleo de materia rodeado por partículas subatómicas con carga eléctrica.[3] A partir de 1846, el físico alemán Wilhelm Eduard Weber teorizó que la electricidad estaba compuesta de fluidos cargados positivamente y negativamente, y que su interacción estaba gobernada por la ley del inverso del cuadrado. Más tarde, tras estudiar el fenómeno de la electrólisis, el físico irlandés George Johnstone Stoney sugirió que existía una «única cantidad definida de electricidad», la carga de un ion monovalente, siendo capaz de estimar el valor de esta carga elemental mediante las leyes de Faraday de la electrólisis.[24] Sin embargo, Stoney creía que estas cargas estaban ligadas permanentemente a átomos y que no podían ser removidas. En 1881, el físico alemán Hermann von Helmholtz argumentó que tanto las cargas positiva como negativa estaban divididas en partes elementales, cada una de las cuales se comportaba como «átomos de electricidad».[4]
En 1894, Stoney estableció el término inglés «electron» para describir estos cambios elementales: «[...] se hizo una estimación de la cantidad real de esta unidad de electricidad fundamental, que es la más destacable, por lo que me he aventurado a sugerir el nombre 'electron'».[25] Dicha palabra «electrón», que deriva del inglés, es una combinación de la palabra «electricidad» y del sufijo griego «patrón» ('el medio por el cual se hace').[26][27]
Descubrimiento

Haz de electrones dentro de un tubo de rayos filiformes siendo desviados siguiendo una trayectoria circular mediante un campo magnético homogéneo.[28][29]
El físico alemán Johann Wilhelm Hittorf emprendió el estudio de la conductividad eléctrica de gases enrarecidos. En 1869, descubrió un brillo emitido desde el cátodo que aumentaba de tamaño cuando el gas disminuía de presión. En 1876, el también físico alemán Eugen Goldstein mostró que los rayos de ese brillo proyectaban una sombra, y los denominó «rayos catódicos».[30] Durante la década de 1870, el químico y físico inglés sir William Crookes desarrolló el primer tubo de rayos catódicos con un vacío elevado (vacío con presión en el rango de 100 mPa a 100 nPa).[31] Entonces mostró que los rayos luminiscentes que aparecían dentro del tubo llevaban energía y que iban del cátodo al ánodo. Además, aplicando un campo magnético, Crookes fue capaz de desviar los rayos, con lo cual demostró que el haz se comportaba como si estuviera cargado negativamente.[32][33] En 1879 propuso que estas propiedades se podían explicar con lo que él denominó «materia radiante». Sugirió que se trataba del cuarto estado de la materia, que consistía en moléculas cargadas negativamente que eran proyectadas a alta velocidad desde el cátodo.[34]
El físico británico nacido en Alemania Arthur Schuster continuó los experimentos iniciados por Crookes colocando placas de metal paralelas a los rayos catódicos y aplicando un potencial eléctrico entre ellas. El campo desviaba los rayos hacia la placa cargada positivamente, lo que evidenciaba aún más que los rayos llevaban una carga negativa. Al medir la cantidad de desviación causada por un cierto nivel de corriente eléctrica, en 1890, Schuster fue capaz de determinar la proporción masa-carga de los componentes de los rayos. Sin embargo, logró un valor que era más de mil veces lo esperado, por lo que, en aquella época, no se dio mucho crédito a sus cálculos.[32][35]
En 1896, el físico británico Joseph John Thomson, junto con sus colegas John Sealy Townsend y Harold Albert Wilson,[16] llevó a cabo experimentos que indicaron que los rayos catódicos eran realmente partículas únicas y no ondas, átomos o moléculas, tal como se creía anteriormente.[6] Thomson hizo buenas estimaciones tanto de la carga como de la masa, y encontró que las partículas de los rayos catódicos —a las cuales llamaba «corpúsculos»— tenían quizás una milésima parte de la masa del ion menos masivo conocido, el ion hidrógeno.[6][17] Asimismo, demostró que su proporción carga-masa (e/m) era independiente del material del cátodo. Más tarde demostró que las partículas cargadas negativamente producidas por materiales radiactivos, por materiales calentados y por materiales iluminados eran universales.[6][36] El nombre de «electrón» para estas partículas fue propuesto de nuevo por el físico irlandés George Francis FitzGerald y, desde entonces, la palabra consiguió una aceptación por partes.[32]

Robert Millikan
En 1896, mientras estudiaba los minerales naturalmente fluorescentes, el físico francés Henri Becquerel descubrió que estos emitían radiación sin estar expuestos a ninguna fuente de energía externa. Estos materiales radiactivos se convirtieron en tema de estudio de interés de muchos científicos, entre ellos el físico neozelandés Ernest Rutherford, que descubrió que emitían partículas. Designó a estas partículas «alfa» y «beta» según su capacidad de penetrar la materia.[37] En 1900, Becquerel demostró que los rayos beta emitidos por el radio podían ser desviados por un campo eléctrico, y que su proporción masa-carga era la misma que la de los rayos catódicos.[38] Esta evidencia reforzó la idea de que los electrones existían en forma de componentes en los átomos.[39][40]
La carga del electrón fue medida con más cuidado por los físicos estadounidenses Robert Millikan y Harvey Fletcher mediante su experimento de la gota de aceite (1909), cuyos resultados fueron publicados en 1911. Este experimento usaba un campo eléctrico para evitar que una gota de aceite cargada cayera como resultado de la gravedad. El aparato era capaz de medir la carga eléctrica tan pequeña como de 1 a 150 iones con un margen de error del 0,3 %. Algunos experimentos similares habían sido llevados a cabo anteriormente por el equipo de Thomson[6] usando nubes de gotas de agua cargadas generadas por electrólisis,[16] y en el mismo año por Abram Ioffe, el cual, de manera independiente, obtuvo el mismo resultado que Millikan usando micropartículas de metales cargadas, publicando sus resultados en 1913.[41] Sin embargo, las gotas de aceite eran más estables que las de agua debido a que su tasa de evaporación es menor, lo cual hacía que fueran más adecuadas para llevar a cabo este tipo de experimentos que duraban largos periodos de tiempo.[42]
Hacia el comienzo del siglo XX se descubrió que, bajo ciertas condiciones, una partícula cargada que se movía rápidamente causaba una condensación de vapor de agua supersaturado a lo largo de su camino. En 1911, Charles Wilson usó este principio para concebir su cámara de niebla, la cual permitía fotografiar los caminos trazados por partículas cargadas tales como electrones.[43]
Teoría atómica

El modelo de Bohr del átomo, muestra estados de electrón con energía cuantificado por el número n. Una caída de electrones a una órbita más baja emite un fotón igual a la diferencia de energía entre las órbitas.
En 1914, los experimentos llevados a cabo hasta ese momento por los físicos Ernest Rutherford, Henry Moseley, James Franck y Gustav Hertz ya habían establecido en gran medida la estructura del átomo como un núcleo denso de carga positiva rodeado por electrones de masa reducida.[44] En 1913, el físico danés Niels Bohr postuló que los electrones residían en estados de energía cuantificados; según él, esta energía estaba determinada por el momento angular de las órbitas del electrón alrededor del núcleo. Los electrones se podían mover entre estos estados —u órbitas— mediante la emisión o absorción de fotones a frecuencias específicas. Por medio de estas órbitas cuantificadas, Bohr explicó las líneas espectrales del átomo de hidrógeno.[45] Sin embargo, el modelo de Bohr fallaba en la justificación de las intensidades relativas de las líneas espectrales, y tampoco tuvo éxito para explicar los espectros de átomos más complejos.[44]
Los enlaces químicos entre átomos fueron explicados por Gilbert Newton Lewis, que en 1916 propuso que un enlace covalente entre dos átomos se mantiene por un par de electrones compartidos entre ellos.[46] Más tarde, en 1923, Walter Heitler y Fritz London dieron una explicación completa sobre la formación de pares de electrones y los enlaces químicos en términos mecánico-cuánticos.[47] En 1919, el químico estadounidense Irving Langmuir amplió el modelo estático del átomo de Lewis y sugirió que todos los electrones eran distribuidos en «capas esféricas sucesivas (casi) concéntricas, todas de grueso idéntico».[48] Estas capas se encontraban, según Langmuir, divididas en un número de celdas en las que cada una contenía un par de electrones. Con este modelo, el científico estadounidense fue capaz de explicar cualitativamente las propiedades químicas de todos los elementos de la tabla periódica, que ya se sabía que se parecían entre sí según la ley periódica formulada por Dmitri Mendeléiev.[49]
En 1924, el físico austriaco Wolfgang Pauli observó que la posible estructura en capas del átomo se podría explicar con un conjunto de cuatro parámetros que definían cada estado cuántico de energía, siempre que cada estado fuera habitado por no más de un electrón.[50] El mecanismo físico para explicar el cuarto parámetro —que tenía dos posibles valores diferentes— fue provisto por los físicos holandeses Samuel Goudsmit y George Uhlenbeck. En 1925, Goudsmit y Uhlenbeck sugirieron que un electrón, adicionalmente al momento angular de su órbita, posee un momento angular intrínseco y un momento dipolar magnético.[44][51] El momento angular intrínseco se convirtió más tarde en lo que se denominaría como espín, y explicaba la anteriormente misteriosa separación de las líneas espectrales observadas con un espectrómetro de alta precisión. Este fenómeno es conocido como desdoblamiento de estructura fina.[52]
Mecánica cuántica
Tras su disertación ocurrida en 1924 de Recherches sur la Theorie des cuánta («Investigación sobre la teoría cuántica»), el físico francés Louis de Broglie propuso la hipótesis de que toda la materia posee una onda similar a la de la contenida en la luz;[53] es decir, en unas condiciones apropiadas, los electrones y demás materia mostrarían propiedades bien de partículas o de ondas. Las propiedades corpusculares de una partícula se hacen evidentes cuando se demuestra que tiene una posición localizada en el espacio a lo largo de su trayectoria en cualquier momento.[54] Se observan en la naturaleza ondas de luz, por ejemplo, cuando un haz de esta pasa a través de rendijas paralelas y crea patrones de interferencia. En 1927, el efecto de interferencia fue demostrado con un haz de electrones por el físico inglés George Paget Thomson con un film delgado de metal, y por los físicos americanos Clinton Davisson y Lester Germer usando un cristal de níquel.[55]

En mecánica cuántica, el comportamiento de un electrón en un átomo se describe por un orbital, que es una distribución de probabilidad más que una órbita. En la figura, el sombreado indica la probabilidad relativa de «encontrar» el electrón en este punto cuando se tiene la energía correspondiente a los números cuánticos dados.
El éxito de la predicción de Broglie llevó a la publicación en 1926 de la ecuación de Schrödinger por Erwin Schrödinger, que describe cómo se propagan las ondas de electrones.[56] En vez de dar una solución que determina la localización de un electrón a lo largo del tiempo, esta ecuación de onda se puede utilizar para predecir la probabilidad de encontrar un electrón cerca de una posición. Este enfoque recibió posteriormente el nombre de «mecánica cuántica»; se trataba de una aproximación extremadamente precisa de los estados de energía de un electrón en un átomo de hidrógeno.[57] Cuando se consideraron el espín y la interacción entre varios electrones, la mecánica cuántica permitió predecir con éxito la configuración de electrones de átomos con números atómicos más altos que el del hidrógeno.[58]
En 1928, trabajando sobre la obra de Wolfgang Pauli, el británico-suizo Paul Dirac concibió un modelo del electrón, la ecuación de Dirac, consistente con la teoría de la relatividad. Dirac aplicó consideraciones relativísticas y simétricas a la formulación hamiltoniana de la mecánica cuántica del campo electromagnético.[59] Para poder resolver algunos problemas de su ecuación relativista, en 1930, Dirac desarrolló un modelo del vacío como un «mar» infinito de partículas con energía negativa, el cual fue llamado «mar de Dirac». Todo ello hizo que Dirac fuera capaz de predecir la existencia del positrón, el homólogo en la antimateria del electrón.[60] Esta partícula fue descubierta en 1932 por Carl David Anderson, quien propuso que los electrones estándar se llamaran «negatrones» y que el término «electrón» se usara como un término genérico para describir las variantes cargadas tanto positiva como negativamente.
En 1947, Willis Eugene Lamb encontró, mientras trabajaba en colaboración con el estudiante de postgrado Robert Rutherford, que ciertos estados cuánticos del átomo de hidrógeno que deberían tener la misma energía se encontraban desplazados los unos respecto de los otros; esta diferencia se denomina desplazamiento de Lamb. Casi al mismo tiempo, Polykarp Kusch, que trabajaba con Henry Michael Foley, descubrió que el momento magnético del electrón es ligeramente mayor que el que predice Dirac con su teoría. Esta pequeña diferencia se llamó a posteriori momento dipolar magnético anómalo del electrón. La diferencia fue explicada más tarde por la teoría de la electrodinámica cuántica desarrollada por Sin-Itiro Tomonaga, Julian Schwinger y Richard Feynman a finales de la década de 1940.[61]
Aceleradores de partículas
Con el desarrollo del acelerador de partículas durante la primera mitad del siglo XX, los físicos empezaron a entrar más a fondo en las propiedades de las partículas subatómicas.[62] El primer intento con éxito de acelerar electrones utilizando la inducción electromagnética fue llevado a cabo en 1942 por Donald Kerst. Su betatrón inicial alcanzaba energías de 2,3 MeV, mientras que los betatrones posteriores podían llegar hasta 300 MeV. En 1947 se descubrió la radiación de sincrotrón gracias a un sincrotrón de electrones de 70 MeV de General Electric; esta radiación era causada por la aceleración de los electrones a través de un campo magnético moviéndose cerca de la velocidad de la luz.[63]
Con una energía del haz de 1,5 GeV, el primer colisionador de partículas de alta energía fue el Adone, que comenzó a operar en 1968.[64] Este aparato aceleraba los electrones y los positrones en direcciones opuestas de tal manera que doblaba la energía de su colisión con respecto al choque de un electrón con un objetivo estático.[65] El Large Electron-Positron collider (LEP) del CERN, que estuvo activo de 1989 a 2000, consiguió energías de colisión de 209 GeV y llevó a cabo importantes descubrimientos para el modelo estándar de física de partículas.[66][67]
Confinamiento de electrones individuales
Actualmente se pueden confinar electrones individuales en transistores CMOS ultrapequeños (L= 20 nm, W= 20 nm) que operan a temperaturas criogénicas (del rango de 4 K a 15 K).[68] La función de onda del electrón se extiende en una retícula semiconductora e interacciona de manera despreciable con la banda de valencia de los electrones, de tal manera que se puede tratar dentro del formalismo de partícula simplemente reemplazando su masa con el tensor de masa efectiva.
Características

El Modelo Estándar de partículas elementales: 12 fermiones fundamentales y 4 bosones fundamentales. Por favor, nótese que las masas de algunas partículas son sujetas a evaluaciones periódicas por la comunidad científica. Los valores actuales reflejados en este gráfico son de 2008 y puede que no hayan sido ajustadas desde ese momento. Para el último consenso, por favor visitar el Particle Data Group.
Clasificación
En el modelo estándar de física de partículas, los electrones pertenecen al grupo de partículas subatómicas llamado leptones, que se cree que son las partículas elementales fundamentales. Los electrones tienen la masa más pequeña de cualquier leptón con carga (y también de cualquier partícula cargada de cualquier tipo) y pertenecen a la primera generación de partículas fundamentales.[69] La segunda y tercera generaciones contienen leptones cargados —el muon y el tau— que son idénticos al electrón en cuanto a la carga, el espín y las interacciones, pero tienen más masa. Los leptones difieren de los otros constituyentes básicos de la materia, los quarks, por su falta de interacción fuerte. Todos los miembros del grupo de los leptones son fermiones, porque todos ellos tienen un espín semientero; puesto que el electrón tiene un espín de 1/2.[70]
Propiedades fundamentales
La masa invariante de un electrón es aproximadamente de 9.109 × 10-31 kg o,[71] equivalentemente, de 5.489 × 10-4uma. Según el principio de equivalencia masa-energía de Einstein, esta masa corresponde a una energía en reposo de 0,511 MeV. La proporción entre la masa de un protón y la de un electrón es aproximadamente de 1836 a 1.[13][72] Medidas astronómicas demuestran que la proporción entre las masas del protón y el electrón han mantenido el mismo valor durante, al menos, la mitad de la edad del universo, tal como predice el modelo estándar.[73]
El electrón tiene una carga eléctrica de -1,602 × 10-19coulomb;[71] esta carga se utiliza como unidad estándar de carga de las partículas subatómicas. Dentro de los límites de la precisión experimental, la carga del electrón es idéntica a la del protón pero con el signo opuesto.[74] Como el símbolo 'e' se utiliza para la carga elemental, el electrón se suele simbolizar por e- (el símbolo - indica la carga negativa). El positrón se simboliza por e+ porque tiene las mismas propiedades que el electrón pero carga positiva.[70][71]
El espín (momento angular intrínseco) del electrón es de 1/2.[71] Esta propiedad se suele indicar, refiriéndose al electrón, como una partícula espín -1/2.[70] Para este tipo de partículas, la magnitud de espín es √3/2 ħ,[nota 3] y el resultado de la medida de la proyección del espín sobre cualquier eje sólo puede ser ±ħ/2. De forma adicional al espín, el electrón tiene un momento magnético a lo largo de su eje[71][75][nota 4] que es aproximadamente un magnetón de Bohr, el cual es una constante física que equivale a 9,27400915 (23) × 10-24joules por tesla.[71] La orientación del espín respecto al momento del electrón define la propiedad de las partículas elementales conocida como helicidad.[76]
El electrón no tiene ninguna subestructura conocida. Es por ello que se define como una partícula puntual con carga puntual y sin extensión espacial. Si se observa un solo electrón mediante una trampa de penning se puede ver que el límite superior del radio de la partícula es de 10-22 metros. Existe una constante física llamada radio clásico del electrón, de un valor mucho mayor (2,8179 × 10-15 m); sin embargo, la terminología proviene de un cálculo simplificado que ignora los efectos de la mecánica cuántica. En realidad, el llamado radio clásico del electrón tiene poco que ver con la estructura fundamental verdadera de esta partícula.[77][nota 5]
Hay partículas elementales que se desintegran espontáneamente en partículas menos masivas. Un ejemplo es el muon, el cual se desintegra en un electrón, un neutrino y un antineutrino, y que tiene una vida media de 2,2 × 10-6 segundos. Sin embargo, se cree que el electrón es estable en terrenos teóricos: el electrón es la partícula de menos masa con una carga eléctrica diferente de cero, por lo que su desintegración violaría la conservación de carga.[78] El límite inferior experimental de la vida media de un electrón es de 4,6 × 1026 años, con un intervalo de confianza del 90 %.[79][80]
Propiedades cuánticas
Como todas las partículas, los electrones pueden actuar como ondas: esto se llama dualidad onda-partícula, y se puede demostrar utilizando el experimento de la doble rendija. La naturaleza similar a la de una onda del electrón le permite pasar a través de dos rendijas paralelas de manera simultánea y no sólo a través de una, como sería el caso de una partícula clásica. En mecánica cuántica, la propiedad similar a la onda de una partícula puede describirse matemáticamente como una función compleja, la función de onda, que se suele denotar por la letra griega psi (ψ). Cuando el valor absoluto de esta función se eleva al cuadrado se obtiene la probabilidad de que una partícula sea observada cerca de una localización (densidad de probabilidad).[81]
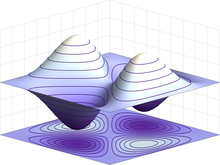
Ejemplo de una función de onda antisimétrica para un estado cuántico de dos fermiones idénticos en una caja de 1 dimensión. Si las partículas conmutan las posiciones, la función de onda invierte su signo.
Los electrones son partículas idénticas porque no se pueden distinguir el uno del otro a partir de sus propiedades físicas intrínsecas. En mecánica cuántica, esto significa que un par de electrones que interaccionan deben ser capaces de intercambiar sus posiciones sin que se produzca un cambio observable en el estado del sistema. La función de onda de los fermiones —grupo dentro del que se incluyen los electrones— es antisimétrica, lo que significa que cambia de signo cuando se intercambian dos electrones, es decir: ψ (r1, r2) =-ψ (r2, r1) (donde las variables r1 y r2 corresponden al primer y segundo electrón, respectivamente). Como el valor absoluto no resulta modificado cuando se cambia el signo, esto corresponde a probabilidades iguales. A diferencia de los fermiones, los bosones —tales como el fotón— tienen funciones de onda simétricas.[81]
En caso de antisimetría, las soluciones de la ecuación de onda para electrones que interaccionan resultan en una probabilidad cero de que cada par pueda ocupar la misma localización (o estado). El principio de exclusión de Pauli se basa en eso: descarta que cualesquiera dos electrones puedan ocupar el mismo estado cuántico. Al mismo tiempo, este principio también explica muchas de las propiedades de los electrones: por ejemplo, que grupos de electrones enlazados ocupen diferentes orbitales de un átomo en lugar de sobreponerse unos a otros en la misma órbita.[81]
Partículas virtuales
Los físicos creen que el espacio vacío podría estar creando de manera continua pares de partículas virtuales —tales como un positrón y un electrón— que se aniquilan rápidamente la una con la otra.[82] La combinación de la variación de energía necesaria para crear estas partículas y el tiempo durante el cual existen caen dentro del límite de detectabilidad que expresa el principio de incertidumbre de Heisenberg, ΔE · Δt ≥ ħ: la energía que se necesita para crear estas partículas virtuales (ΔE) se puede «sacar» del vacío durante un periodo de tiempo (Δt) de tal manera que su producto no sea más elevado que la constante de Planck reducida (ħ ≈ 6,6 × 10-16eV·s). De ello se extrae, pues, que por un electrón virtual Δt es como máximo 1,3 × 10-21 s.[83]

Una representación esquemática de pares electrón-positrón virtuales que aparecen de forma aleatoria cerca de un electrón (abajo a la izquierda)
Mientras existe un par virtual electrón-positrón, la fuerza de Coulomb del campo eléctrico del entorno que rodea al electrón hace que el positrón creado sea atraído al electrón original, mientras que un electrón creado experimenta una repulsión. Esto causa lo que se conoce como polarización del vacío. El vacío se comporta, pues, como un medio que tiene una permitividad dieléctrica mayor que la unidad. En consecuencia, la carga efectiva del electrón es realmente menor que su valor real, y la carga decrece cuando aumenta la distancia respecto del electrón.[84][85] Esta polarización fue confirmada de manera experimental en 1997 mediante el acelerador de partículas japonés TRISTAN.[86] Las partículas virtuales causan un efecto pantalla similar para la masa del electrón.[87]
La interacción con partículas virtuales también explica la pequeña desviación (de aproximadamente el 0,1 %) del momento magnético intrínseco del electrón respecto al magnetón de Bohr (el momento dipolar magnético anómalo).[75][88] La coincidencia extraordinariamente precisa entre esta diferencia predicha y el valor determinado experimentalmente se considera uno de los grandes éxitos de la electrodinámica cuántica.[89]
En física clásica, el momento angular y el momento magnético de un objeto dependen de sus dimensiones físicas. Es por ello que el concepto de un electrón sin dimensiones que tenga estas propiedades puede parecer inconsistente. Esta aparente paradoja se puede explicar por la formación de fotones virtuales en el campo eléctrico general para el electrón: estos fotones hacen que el electrón haga un movimiento de vibración ultrarrápido (lo que se conoce como «zitterbewegung»),[90] que tiene como resultado un movimiento circular limpio con precesión. Este movimiento es el que produce el espín y el momento magnético del electrón.[14][91] En los átomos, esta creación de fotones virtuales explica el desplazamiento de Lamb que se observa en las líneas espectrales.[84]
Interacción

Animación que muestra dos átomos de oxígeno fusionándose para formar una molécula de O2 en su estado cuántico fundamental. Las nubes de color representan los orbitales atómicos. Los orbitales 2s y 2p de cada átomo se combinan para formar los orbitales σ y π de la molécula, que la mantienen unida. Los orbitales 1s, más interiores, no se combinan y permiten distinguir a cada núcleo.
Un electrón genera un campo eléctrico que ejerce una fuerza de atracción sobre una partícula de carga positiva (tal como el protón) y una carga de repulsión sobre una partícula de carga negativa. La magnitud de esta fuerza se determina mediante la ley de Coulomb del inverso del cuadrado.[92] Cuando un electrón está en movimiento genera un campo magnético.[93] La ley de Ampère-Maxwell relaciona el campo magnético con el movimiento masivo de los electrones (la corriente eléctrica) respecto de un observador. Esta propiedad de inducción, por ejemplo, es la que da el campo magnético necesario para hacer funcionar un motor eléctrico.[94] El campo electromagnético de una partícula cargada de movimiento arbitrario se expresa mediante los potenciales de Liénard-Wiechert, los cuales son válidos incluso cuando la velocidad de la partícula es cercana a la de la luz (relatividad).

Una partícula con carga q (a la izquierda) se mueve con velocidad v a través de un campo magnético B que se orienta hacia el espectador. Para un electrón, q es negativa por lo que sigue una trayectoria curvada hacia la parte superior.
Cuando un electrón se mueve a través de un campo magnético está sujeto a la fuerza de Lorentz, la cual ejerce una influencia en una dirección perpendicular al plano definido por el campo magnético y la velocidad del electrón. La fuerza centrípeta hace que el electrón siga una trayectoria helicoidal a través del campo con un radio que se llama radio de Larmor. La aceleración de este movimiento curvado induce al electrón a radiar energía en forma de radiación sincrotrón.[95][96][nota 6] La emisión de energía, a su vez, causa un retroceso del electrón conocido como fuerza de Abraham-Lorentz, que crea una fricción que ralentiza el electrón. Esta fuerza es causada por una reacción inversa del mismo campo del electrón sobre sí mismo.[97]
En electrodinámica cuántica, la interacción electromagnética entre partículas es mediada por fotones. Un electrón aislado que no está sufriendo ninguna aceleración no es capaz de emitir o absorber un fotón real, si lo hiciera violaría la conservación de la energía y la cantidad de movimiento. En lugar de ello, los fotones virtuales pueden transferir cantidad de movimiento entre dos partículas cargadas.[98] Este intercambio de fotones virtuales genera, por ejemplo, la fuerza de Coulomb. La emisión de energía puede tener lugar cuando un electrón en movimiento es desviado por una partícula cargada (por ejemplo, un protón). La aceleración del electrón tiene como resultado la emisión de radiación Bremsstrahlung.[99]
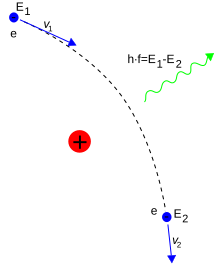
Aquí, un electrón e desviado por el campo eléctrico de un núcleo atómico produce prenorradiación. El cambio de energía E2 − E1 determina la frecuencia f del fotón emitido.
Una colisión inelástica entre un fotón (luz) y un electrón solitario (libre) se llama difusión Compton. Esta colisión resulta en una transferencia de cantidad de movimiento y energía entre las partículas que modifica la longitud de onda del fotón en un fenómeno denominado desplazamiento de Compton.[nota 7] La máxima magnitud de este desplazamiento de longitud de onda es h/mec, lo que se conoce como longitud de onda de Compton,[100] que para el electrón toma un valor de 2,43 × 10-12 m.[71] Cuando la longitud de onda de la luz es larga (por ejemplo, la longitud de onda de la luz visible es de 0,4-0,7 micras) el desplazamiento de la longitud de onda se convierte despreciable. Este tipo de interacción entre la luz y electrones libres se llama difusión Thomson.[101]
La magnitud relativa de la interacción electromagnética entre dos partículas cargadas, tales como un electrón y un protón, viene dada por la constante de estructura fina. Esta constante es una cantidad adimensional y representa la proporción entre dos energías: la energía electrostática de atracción (o repulsión) en una separación de una longitud de onda de Compton, y el resto de energía de la carga. Tiene un valor de α ≈ 7,297353 × 10-3, que equivale aproximadamente a 1/137.[71]
Cuando colisionan electrones y positrones se aniquilan unos a otros y dan lugar a dos o más fotones de rayos gamma. Si el electrón y el positrón tienen una cantidad de movimiento despreciable se puede formar un positronio antes de que la aniquilación resulte en dos o tres fotones de rayos gamma de un total de 1.022 MeV.[102][103] Por otro lado, los fotones de alta energía pueden transformarse en un electrón y un positrón mediante el proceso conocido como creación de pares, pero sólo con la presencia cercana de una partícula cargada, como un núcleo.[104][105]
Según la teoría de la interacción electrodébil, la componente izquierdista de la función de onda del electrón forma un doblete de isospín débil con el neutrino electrónico. Esto significa que, durante las interacciones débiles, los neutrinos electrónicos se comportan como si fueran electrones. Cualquiera de los miembros de este doblete pueden sufrir una interacción de corriente cargado emitiendo o absorbiendo un W y ser absorbidos por el otro miembro. La carga se conserva durante esta reacción porque el bosón W también lleva una carga, por lo que se cancela cualquier cambio neto durante la transmutación. Las interacciones de corriente cargadas son responsables del fenómeno de la desintegración beta en un átomo radiactivo. Finalmente, tanto el electrón como el neutrino electrónico pueden sufrir una interacción de corriente neutral mediante un intercambio de Z0. Este tipo de interacciones son responsables de la difusión elástica neutrino-electrón.[106]
Átomos y moléculas
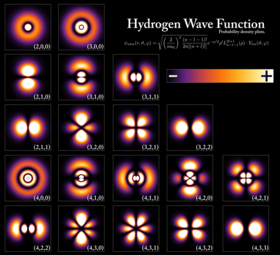
Densidades de probabilidad para los primeros átomos orbitales de hidrógeno, visto en sección transversal. El nivel de energía de un electrón ligado determina el orbital que ocupa, y el color refleja la probabilidad de encontrar el electrón en una posición dada.
Un electrón puede estar enlazado al núcleo de un átomo por la fuerza de atracción de Coulomb. Un sistema de uno o más electrones enlazados a un núcleo se denomina átomo. Si el número de electrones es diferente a la carga eléctrica del núcleo, entonces el átomo se llama ion. El comportamiento similar al de una onda de un electrón enlazado se describe por una función llamada orbital atómico. Cada orbital tiene su propio conjunto de números cuánticos —tales como energía, momento angular y proyección del momento angular— y sólo existe un conjunto discreto de estos orbitales alrededor del núcleo. Según el principio de exclusión de Pauli, cada orbital puede ser ocupado hasta por dos electrones, los cuales no pueden tener el mismo número cuántico de espín.
Los electrones se pueden transferir entre diferentes orbitales mediante la emisión o absorción de fotones con una energía que coincida con la diferencia de potencial.[107] Otros métodos de transferencia orbital son las colisiones con partículas y el efecto Auger.[108] Para poder escapar del átomo, la energía del electrón se incrementará por sobre la energía que le liga al átomo. Esto ocurre, por ejemplo, en el efecto fotoeléctrico, en el que un fotón incidente que supera la energía de ionización del átomo es absorbido por el electrón.[109]
El momento angular orbital de los electrones está cuantificado. Como el electrón está cargado, produce un momento magnético orbital proporcional al momento angular. El momento magnético neto de un átomo equivale al vector suma de los momentos magnéticos de espín y orbitales de todos los electrones y el núcleo. El momento magnético del núcleo es despreciable comparado con el de los electrones. Los momentos magnéticos de los electrones que ocupan el mismo orbital (que se llaman electrones apareados) se simplifican entre sí.[110]
El enlace químico entre átomos existe como resultado de las interacciones electromagnéticas, tal como describen las leyes de la mecánica cuántica.[111] Los enlaces más fuertes están formados por la compartición o la transferencia de electrones entre átomos, lo que permite la formación de moléculas.[18] Dentro de una molécula, los electrones se mueven bajo la influencia de muchos núcleos y ocupan orbitales moleculares, de igual manera que pueden ocupar orbitales atómicos en átomos aislados.[112] Un factor fundamental de estas estructuras moleculares es la existencia de pares de electrones: se trata de electrones con espines opuestos, lo que les permite ocupar el mismo orbital molecular sin violar el principio de exclusión de Pauli (igual que ocurre en el átomo). Los diferentes orbitales moleculares tienen una distribución espacial distinta de la densidad de electrones. Por ejemplo, en pares enlazados (es decir, en los pares que enlazan átomos juntos) los electrones se pueden encontrar con mayor probabilidad en un volumen relativamente pequeño alrededor del núcleo. Por otro lado, en pares no enlazados los electrones están distribuidos en un volumen grande alrededor del núcleo.[113]
Conductividad

Un rayo consiste básicamente de un flujo de electrones.[114] El potencial eléctrico necesario para que exista el rayo puede ser generado para un efecto triboeléctrico.[115][116]
Si un cuerpo tiene más o menos electrones de los necesarios para equilibrar la carga positiva del núcleo, entonces este objeto tiene una carga eléctrica neta. Cuando hay un exceso de electrones, se dice que este objeto está cargado negativamente, por otra parte, cuando hay una escasez de electrones (menos electrones que protones en el núcleo), se dice que este objeto está cargado positivamente. Cuando el número de protones y de electrones son equivalentes, las cargas se cancelan y se dice que el objeto es eléctricamente neutro. En un cuerpo macroscópico puede aparecer una carga eléctrica si se frota, lo que se explica por el efecto triboeléctrico.[117]
Los electrones independientes que se mueven en el vacío se llaman electrones libres. Los electrones de metales se comportan como si fueran libres. En realidad, las partículas de los metales y otros sólidos que se denominan normalmente electrones son quasielectrones (quasipartículas): tienen la misma carga eléctrica, espín y momento magnético que los electrones reales pero pueden tener una masa diferente.[118] Cuando los electrones libres —tanto en el vacío como en un metal— se mueven, producen un flujo neto de carga llamado corriente eléctrica que genera un campo magnético. De la misma manera, se puede crear una corriente eléctrica mediante un campo magnético variable. Estas interacciones son descritas matemáticamente por las ecuaciones de Maxwell.[119]
A una temperatura dada, cada material tiene una conductividad eléctrica que determina el valor de la corriente eléctrica cuando se aplica un potencial eléctrico. Algunos ejemplos de buenos conductores son los metales como el cobre y el oro, mientras que el vidrio y el teflón son malos conductores. En cualquier material dieléctrico, los electrones permanecen enlazados a sus respectivos átomos y el material se comporta como un aislante. La mayoría de semiconductores tienen un nivel variable de conductividad que está entre los extremos de conductor y aislante.[120] Por otra parte, los metales poseen una estructura de banda electrónica que contiene bandas electrónicas rellenadas parcialmente. La presencia de estas bandas permite a los electrones de los metales comportarse como si fueran electrones libres o desapareados. Estos electrones no se asocian con átomos específicos, por lo que, cuando se aplica un campo eléctrico, tienen libertad de movimiento a través del material como si fueran un gas (lo que se denomina como gas de Fermi)[121] igual que si fueran electrones libres.
Debido a las colisiones entre electrones y átomos, la velocidad derivada de los electrones en un conductor se representa por medio de los milímetros por segundo. Sin embargo, la velocidad a la que un cambio de corriente en un punto del material causa cambios en las corrientes de otras partes del material (velocidad de propagación) suele ser un 75 % de la velocidad de la luz.[122] Esto explica porqué los impulsos eléctricos se propagan en forma de onda, su velocidad depende de la constante dieléctrica del material.[123]
Los metales son unos conductores del calor relativamente buenos, básicamente porque los electrones deslocalizados se encuentran libres para transportar energía térmica entre átomos. Sin embargo, a diferencia de la conductividad eléctrica, la conductividad térmica de un metal es casi independiente de la temperatura. Esto se expresa matemáticamente por la ley de Wiedemann-Franz,[121] que postula que la proporción de la conductividad térmica con respecto a la conductividad eléctrica es proporcional a la temperatura. El desorden térmico de la red metálica incrementa la resistividad eléctrica del material, lo que produce una dependencia de la temperatura por la corriente eléctrica.[124]
Cuando los materiales se enfrían por debajo de un punto llamado punto crítico pueden sufrir un cambio de fase en el que pierden toda la resistividad a la corriente eléctrica, en un proceso que se conoce como superconductividad. En la teoría BCS, este comportamiento se modela con pares de electrones que entran en un estado cuántico conocido como condensado de Bose-Einstein. Estos pares de Cooper[125] tienen su movimiento emparejado en materia cercana mediante vibraciones de la red conocidas como fonones[126] y, de esta manera, evitan las colisiones con átomos; de no ser así, se crearía resistencia eléctrica. Sin embargo, el mecanismo por el cual operan los superconductores de alta temperatura permanece incierto.
Cuando se confinan con firmeza los electrones dentro de sólidos conductores —que son quasipartículas— a temperaturas cercanas al cero absoluto, se comportan como si se dividieran en dos otras quasipartículas: espinones y holones.[127][128] El primero es el que se encarga del espín y del momento magnético, mientras que el segundo lleva la carga eléctrica.
Movimiento y energía
Según la teoría de la relatividad especial de Einstein, cuando la velocidad de un electrón se aproxima a la velocidad de la luz, desde el punto de vista de un observador, su masa relativística incrementa, lo que hace que sea cada vez más difícil acelerarlo dentro del marco de referencia del observador. La velocidad del electrón se puede aproximar, pero nunca llegar a la velocidad de la luz en el vacío, c. Sin embargo, cuando los electrones relativistas —es decir, electrones que se mueven a una velocidad cercana a c— insertados en un medio dieléctrico como el agua —en el que la velocidad local de la luz es mucho menor que c— viajan temporalmente más rápido que la luz en este medio. Mediante su interacción con el medio generan una luz tenue que se llama radiación de Cherenkov.[129]

Factor de Lorentz como una función de la velocidad. Se inicia en el valor 1 y se va hasta el infinito tantas v como enfoques c.
Los efectos de la relatividad especial se basan en una cantidad conocida como el factor de Lorentz, que se define como γ=1/1−v2/c2{displaystyle scriptstyle gamma =1/{sqrt {1-{v^{2}}/{c^{2}}}}}
- Ke=(γ−1)mec2,{displaystyle displaystyle K_{mathrm {e} }=(gamma -1)m_{mathrm {e} }c^{2},}
donde me es la masa del electrón. Por ejemplo, el acelerador lineal de Stanford puede acelerar un electrón hasta aproximadamente unos 51 GeV.[130] Como un electrón se comporta como una onda, donde determinada velocidad poseerá una longitud de onda de De Broglie que viene dada por λe=h/p, donde h es la constante de Planck y p es la cantidad de movimiento.[53] Para el electrón de 51 GeV mencionado anteriormente, la longitud de onda obtenida es de aproximadamente 2,4 × 10-17 m, lo suficientemente pequeña para poder explorar estructuras de tamaño muy inferior a la del núcleo atómico.[131]
Formación

Producción de pares causada por la colisión de un fotón con un núcleo atómico
La teoría del Big Bang es la teoría científica más aceptada para explicar las primeras etapas de la evolución del universo.[132] Durante el primer milisegundo del Big Bang, las temperaturas estaban por encima de 1010K y los fotones tenían energías medias superiores a un millón de eV, siendo suficientemente energéticos para poder reaccionar entre sí formando pares electrón-positrón. Del mismo modo, estos pares se aniquilaron los unos a otros y emitieron fotones energéticos:
γ + γ ↔ e+ + e-
Durante esta fase de la evolución del Universo se mantuvo un equilibrio entre los electrones, los positrones y los fotones. Después de que hubieran pasado 15 segundos, la temperatura del Universo bajó por debajo del límite que permitía la formación de electrones-positrones. La mayoría de las partículas que sobrevivieron se aniquilaron unas a otras liberando radiación gamma, la cual recalentó brevemente el Universo.[133]
Por razones que todavía permanecen inciertas, durante el proceso de leptogénesis hubo un exceso de número de electrones respecto al de positrones.[134] Es por ello que alrededor de un electrón por cada millardo sobrevivieron al proceso de aniquilación. Este exceso coincidía con el de protones respecto al de antiprotones (condición que se conoce como asimetría bariónica), lo que resulta en una carga neta del Universo nulo.[135][136] Los neutrones y protones que sobrevivieron comenzaron a participar en reacciones los unos con otros en un proceso conocido como nucleosíntesis, en el que se formaban isótopos de hidrógeno y helio con trazas de litio. Este proceso alcanzó su máximo después de más o menos cinco minutos.[137] Todos los neutrones sobrantes sufrieron una desintegración beta negativa con una semivida de un millar de segundos; durante este proceso se liberaron un protón y un electrón por cada neutrón:
n → p + e- + ν-e
Durante los 300 000-400 000 años siguientes, el exceso de electrones todavía era demasiado energético para poder enlazarse con los núcleos atómicos.[138] Lo que siguió a este periodo se conoce como recombinación: es decir, se formaron átomos neutrales y el Universo en expansión se convirtió transparente a la radiación.[139]
Más o menos un millón de años después del Big Bang se empezó a formar la primera generación de estrellas.[139] Dentro de una estrella, la nucleosíntesis estelar tiene como resultado la producción de positrones a partir de la fusión de núcleos atómicos. Estas partículas de antimateria se aniquilan inmediatamente con electrones, lo que libera rayos gamma. El resultado neto es una reducción firme del número de electrones y un correspondiente incremento del número de neutrones. Sin embargo, el proceso de evolución estelar puede resultar en la síntesis de isótopos radiactivos. Algunos isótopos pueden sufrir una desintegración beta negativa por la que emiten un electrón y un antineutrón del núcleo.[140] Un ejemplo de ello es el isótopo cobalto-60 (60Co), que se desintegra para formar níquel-60 (60Ni).[141]

Una ducha al aire ampliado generada por un rayo cósmico energético que golpea la atmósfera de la Tierra
Al final de su ciclo de vida, una estrella de más de unas 20 masas solares puede sufrir un colapso gravitatorio y formar un agujero negro.[142] Según la física clásica, estos objetos estelares masivos ejercen una atracción gravitatoria lo suficientemente fuerte como para impedir que nada —ni siquiera la radiación electromagnética— escape más allá del radio de Schwarzschild. Sin embargo, se cree que los efectos mecánico-cuánticos podrían permitir que se emitiera radiación Hawking a esa distancia. También se piensa que se crean electrones (y positrones) en el horizonte de eventos de estas estrellas remanentes.
Cuando se crean pares de partículas virtuales (tales como el electrón y el positrón) en las inmediaciones del horizonte de eventos, la distribución espacial aleatoria de estas partículas puede permitir que una de ellas aparezca en el exterior: este proceso se conoce como «efecto túnel». El potencial gravitatorio del agujero negro puede entonces aportar la energía que transforma esta partícula virtual en una partícula real, lo que permite que sea radiada hacia el espacio.[143] A cambio de esto, el otro miembro del par recibe energía negativa, lo que resulta en una pérdida neta de masa-energía del agujero negro. La tasa de radiación de Hawking incrementa cuando la masa decrece, lo que lleva finalmente a la evaporación del agujero negro hasta que, al final, explota.[144]
Los rayos cósmicos son partículas que viajan por el espacio con altas energías. Se han documentado eventos de energías tan altas como de 3,0 × 1020 eV.[145] Cuando estas partículas colisionan con nucleones de la atmósfera terrestre, se genera una cascada de partículas, entre ellas piones.[146] Más de la mitad de la radiación cósmica observada desde la superficie de la Tierra consiste en muones. Estas partículas, los muones, son leptones producidos en la atmósfera superior a partir de la desintegración de piones:
π- → μ− + ν−μ
A su vez, un muon se puede desintegrar para formar un electrón o un positrón:[147]
μ− → e- + ν−e + ν−μ
Observación

Las auroras están causadas principalmente por electrones energéticos precipitándose en la atmósfera.[148]
La observación remota de electrones requiere la detección de su energía radiada. Por ejemplo, en ambientes de alta energía tales como una corona estelar los electrones libres forman plasma que radia energía debido a la radiación de frenado. El gas de electrones puede sufrir una oscilación de plasma, que consiste en ondas causadas por variaciones sincronizadas de la densidad electrónica que producen emisiones energéticas que se pueden detectar usando radiotelescopios.[149]
La frecuencia de un fotón es proporcional a su energía. Cuando un electrón enlazado se mueve entre diferentes niveles de energía del átomo, este absorbe o emite fotones a frecuencias características. Por ejemplo, cuando los átomos son irradiados por una fuente con un espectro amplio, aparecen diferentes líneas de absorción en el espectro de la radiación transmitida. Cada elemento o molécula muestra un conjunto característico de líneas espectrales (tal y como en el caso de las líneas espectrales del hidrógeno). Las medidas espectroscópicas de la magnitud y amplitud de estas líneas permite determinar la composición y las propiedades físicas de una sustancia.[150][151]
En condiciones de laboratorio, las interacciones de electrones individuales se pueden observar mediante detectores de partículas, los cuales permiten medir propiedades específicas tales como energía, espín y carga.[109] El desarrollo de la trampa de Paul y de la trampa de Penning posibilita tener partículas cargas contenidas dentro de una pequeña región durante largas duraciones de tiempo, lo que permite realizar medidas precisas de las propiedades de las partículas. Por ejemplo, una vez una trampa de Penning fue utilizada para contener un solo electrón durante un período de 10 meses.[152] El momento magnético del electrón fue medido con una precisión de once dígitos, lo cual, en 1980, fue de una precisión mayor que la de cualquier otra constante física.[153]
Las primeras imágenes en vídeo de la distribución de energía de un electrón fueron grabadas por un equipo de la Universidad de Lund (Suecia) en febrero de 2008. Los científicos usaron flashes de luz extremadamente cortos —llamados pulsos de Attosegon— los cuales permitieron observar el movimiento de un electrón por primera vez.[154][155] La distribución de los electrones en materiales sólidos se puede visualizar mediante la espectroscopia de fotoemisión resuelta en ángulo (ARPAS, en sus siglas en inglés). Esta técnica utiliza el efecto fotoeléctrico para medir el espacio recíproco (una representación matemática de estructuras periódicas que se utiliza para inferir la estructura original). El ARPES se puede usar para determinar la dirección, velocidad y difusión de los electrones dentro del material.[156]
Aplicaciones del plasma

Un haz de electrones es dirigido hacia una maqueta del transbordador espacial dentro de un túnel de viento de la NASA para simular el efecto de ionización de los gases durante la reentrada atmosférica.[157]
Haces de partículas
Los haces de electrones se utilizan para llevar a cabo la soldadura por haz de electrones,[158] la cual permite conseguir densidades energéticas de hasta 107 W·cm-2 en una región de diámetro de un rango tan pequeño como de 0,1-1,3 mm; además, normalmente no requiere disponer de ningún material de aportación. Esta técnica de soldadura se lleva a cabo en el vacío, de tal forma que el haz de electrones no interaccione con el gas antes de llegar al objetivo. Se usa para juntar materiales conductores que, de otra manera, no podrían ser soldados.[159][160]
La litografía por haz de electrones (EBL, en su acrónimo en inglés) es un método para grabar semiconductores a resoluciones más pequeñas que un micrómetro.[161] Las limitaciones de esta técnica son el alto costo, el bajo rendimiento, la necesidad de operar el haz en el vacío y la tendencia de los electrones de dispersarse en sólidos. Este último problema limita la resolución a más o menos 10 nm. Por esta razón, la litografía por haz de electrones se utiliza primordialmente para la producción de pequeñas cantidades de circuitos integrados especializados.[162]
El tratamiento por haz de electrones se utiliza para irradiar materiales con tal de modificar sus propiedades físicas, así como para esterilizar productos médicos y alimenticios.[163] En radioterapia, los haces de electrones se generan con aceleradores lineales para tratar tumores superficiales. Como el haz de electrones sólo puede penetrar hasta una profundidad determinada antes de ser absorbido —normalmente hasta 5 cm por electrones de energías entre el rango de 5-20 MeV—. La teleradioterapia mediante electrones es útil para tratar lesiones de la piel tales como carcinomas basocelulares. Un haz de electrones se puede utilizar para complementar el tratamiento de áreas que han sido irradiadas con rayos X.[164][165]
Los aceleradores de partículas hacen uso de los campos eléctricos para propulsar los electrones y sus antipartículas a energías elevadas. Cuando estas partículas pasan a través de campos magnéticos emiten radiación sincrotrónica. La intensidad de esta radiación depende del espín, lo que causa la polarización del haz de electrones: este proceso se conoce como efecto Sokolov-Ternov. Los haces de electrones polarizados pueden ser útiles para diversos tipos de experimentos. La radiación sincrotrónica también se puede usar para enfriar los haces de electrones, lo que reduce la dispersión de cantidad de movimiento de las partículas. Cuando las partículas han acelerado a las energías necesarias se provoca una colisión de haces separados de electrones y positrones. Las emisiones de energía resultantes se observan con detectores de partículas y se estudian en el campo de la física de partículas.[166]
Creación de imágenes
La difracción de electrones de baja energía (LEED, de sus siglas en inglés) es un método que consiste en bombardear un material cristalino con un brote limitado de electrones y entonces observar los patrones de difracción que resultan con tal de determinar la estructura del material. La energía necesaria para los electrones es del rango de 20 a 200 eV.[167] La técnica de difracción de electrones reflejados de alta energía (RHEED, de sus siglas en inglés) utiliza la reflexión de un haz de electrones disparado a varios ángulos pequeños para caracterizar la superficie de materiales cristalinos. La energía del haz suele estar en el rango de 8-20 keV y el ángulo de incidencia entre 1-4 °.[168][169]
El microscopio electrónico dirige un haz localizado de electrones a un objeto. Cuando el haz interacciona con el material, algunos electrones cambian de propiedades como, por ejemplo, la dirección de movimiento, el ángulo, la fase relativa y la energía. Si se toma nota de estos cambios del haz de electrones, los microscopios pueden producir una imagen a nivel atómico del material.[170] Bajo luz azul, los microscopios ópticos convencionales tienen una resolución limitada por la difracción de unos 200 nm;[171] en comparación, los microscopios electrónicos están limitados por la longitud de onda de De Broglie del electrón. Esta longitud de onda, por ejemplo, es de 0,0037 nm por electrones que se aceleran en un potencial de 100 000 voltios.[172] El microscopio electrónico de transmisión de aberración corregida es capaz de conseguir una resolución por debajo de los 0,05 nm, que es más que suficiente para estudiar átomos individuales.[173] Esta capacidad convierte al microscopio electrónico en un instrumento de laboratorio muy útil para formar imágenes de alta resolución. Sin embargo, los microscopios electrónicos son aparatos muy caros y costosos de mantener.
Existen dos tipos principales de microscopios electrónicos: los de transmisión y los de rastreo. Los microscopios electrónicos de transmisión funcionan de una manera similar que un retroproyector: un haz de electrones pasa a través de una banda de material y entonces es proyectado mediante lentes en un film fotográfico o un detector CCD. Por otra parte, los microscopios electrónicos de barrido producen la imagen mediante el rastreo de un haz de electrones localizado a lo largo de la muestra estudiada. La magnificación va desde 100 × hasta 1,000,000 × o más para ambos tipos de microscopios. Finalmente, el microscopio de efecto túnel se basa en el efecto túnel de electrones que circulan entre un electrodo afilado y el material estudiado para generar imágenes de resolución atómica de su superficie.[174][175][176]
Otras aplicaciones
En el láser de electrones libres (FEL, de las siglas en inglés) se hace pasar un haz de electrones relativistas a través de un par de onduladores que contienen matrices de imanes dipolares, que se caracterizan por poseer campos magnéticos con direcciones alternadas. Los electrones emiten radiación sincrotrón que, a su vez, interacciona coherentemente con los mismos electrones. Esto conduce a una fuerte amplificación del campo de radiación a la frecuencia de resonancia. El FEL puede emitir una radiación electromagnética coherente de alto brillo con un ancho rango de frecuencias que va desde las microondas hasta los rayos X suaves. Estos aparatos podrían utilizarse en un futuro para tareas de fabricación, comunicación y también para aplicaciones médicas tales como cirugía de tejidos blandos.[177]
Los electrones se encuentran en el corazón de los tubos de rayos catódicos, que han sido muy utilizados como aparatos de visualización de instrumentos de laboratorio, monitores de ordenador y televisores.[178] En un tubo fotomultiplicador, cada fotón que choca con el fotocátodo inicia una avalancha de electrones que produce un pulso de corriente detectable.[179] Los tubos de vacío utilizan el flujo de electrones para manipular señales eléctricas; tuvieron un papel esencial en el desarrollo de la tecnología electrónica. Sin embargo, actualmente ya han sido reemplazados por aparatos de estado sólido tales como el transistor.[180]
Véase también
- Capa electrónica
- Configuración electrónica
- Modelo estándar de física de partículas
- Electricidad
Fuentes
Notas
↑ La versión fraccional del denominador es el inverso del valor decimal (junto con su incertidumbre estándar relativa de 4.2×10−13u).
↑ La carga del electrón representa una carga elemental de tipo negativo, difiriendo en el caso del protón; cuando adquiere un valor positivo.
↑ Esta magnitud se obtiene del número cuántico del espín cuando
- S=s(s+1)⋅h2π=32ℏ{displaystyle {begin{alignedat}{2}S&={sqrt {s(s+1)}}cdot {frac {h}{2pi }}\&={frac {sqrt {3}}{2}}hbar \end{alignedat}}}
Para el número cuántico s = 1/2.
Véase: Gupta, M. C. (2001). Atomic and Molecular Spectroscopy. New Age Publishers. p. 81. ISBN 81-224-1300-5.
- S=s(s+1)⋅h2π=32ℏ{displaystyle {begin{alignedat}{2}S&={sqrt {s(s+1)}}cdot {frac {h}{2pi }}\&={frac {sqrt {3}}{2}}hbar \end{alignedat}}}
↑ :μB=eℏ2me.{displaystyle textstyle mu _{mathrm {B} }={frac {ehbar }{2m_{mathrm {e} }}}.}
↑ El radio clásico del electrón se obtiene de la siguiente manera: se asume que la carga del electrón está distribuida uniformemente en un volumen esférico. Como parte de la esfera repelerá las demás partes, puesto que la esfera contiene energía potencial electrostática. Esta energía es igual a la energía en reposo del electrón, definida por la relatividad especial (E = mc2). A partir de la teoría de la electrostática, la energía potencial de una esfera con radio r y carga e vienen dados por:
- Ep=e28πε0r{displaystyle E_{mathrm {p} }={frac {e^{2}}{8pi varepsilon _{0}r}}}
donde ε0 es la permitividad del vacío. Para un electrón de masa en reposo m0, la energía en reposo equivale a:
- Ep=m0c2{displaystyle textstyle E_{mathrm {p} }=m_{0}c^{2}}
donde c es la velocidad de la luz en el vacío. Igualando las expresiones y despejando r se obtiene el radio clásico del electrón.
Véase: Haken, H.; Wolf, H. C.; Brewer, W. D. (2005). The Physics of Atoms and Quanta: Introduction to Experiments and Theory. Springer. p. 70. ISBN 3-540-67274-5.
- Ep=e28πε0r{displaystyle E_{mathrm {p} }={frac {e^{2}}{8pi varepsilon _{0}r}}}
↑ La radiación de electrones no relativística a veces se denomina radiación ciclotrón.
↑ El cambio de longitud de onda, Δλ, depende del ángulo de retroceso, θ, tal y como se aprecia aquí,
- Δλ=hmec(1−cosθ),{displaystyle textstyle Delta lambda ={frac {h}{m_{mathrm {e} }c}}(1-cos theta ),}
donde c es a velocidad de la luz en el vacío y me es la masa del electrón. Véase Zombeck (2007: 393, 396).
- Δλ=hmec(1−cosθ),{displaystyle textstyle Delta lambda ={frac {h}{m_{mathrm {e} }c}}(1-cos theta ),}
Referencias
↑
Dahl, P.F. (1997). Flash of the Cathode Rays: A History of J J Thomson's Electron. CRC Press. p. 72. ISBN 0-7503-0453-7.
↑ ab
Eichten, E. J.; Peskin, M. E.; Peskin, M. (1983). «New Tests for Quark and Lepton Substructure». Physical Review Letters 50 (11): 811-814. Bibcode:1983PhRvL..50..811E. doi:10.1103/PhysRevLett.50.811.
↑ ab
Farrar, W. V. (1969). «Richard Laming and the Coal-Gas Industry, with His Views on the Structure of Matter». Annals of Science 25 (3): 243-254. doi:10.1080/00033796900200141.
↑ abc
Arabatzis, T. (2006). Representing Electrons: A Biographical Approach to Theoretical Entities. University of Chicago Press. pp. 70-74. ISBN 0-226-02421-0.
↑
Buchwald, J. Z.; Warwick, A. (2001). Histories of the Electron: The Birth of Microphysics. MIT Press. pp. 195-202. ISBN 0-262-52424-4.
↑ abcdef
Thomson, J. J. (1897). «Cathode Rays». Philosophical Magazine 44: 293.
↑ Mohr, Peter J.; Taylor, Barry N.; Newell, David B. (2008). «CODATA Recommended Values of the Fundamental Physical Constants: 2006». Reviews of Modern Physics 80: 633-730. doi:10.1103/RevModPhys.80.633. Enlace directo.
↑ Mohr, Peter J.; Taylor, Barry N.; Newell, David B. (2008). «CODATA Recommended Values of the Fundamental Physical Constants: 2006». Reviews of Modern Physics 80: 633-730. doi:10.1103/RevModPhys.80.633. Enlace directo.
↑ Mohr, Peter J.; Taylor, Barry N.; Newell, David B. (2008). «CODATA Recommended Values of the Fundamental Physical Constants: 2006». Reviews of Modern Physics 80: 633-730. doi:10.1103/RevModPhys.80.633. Enlace directo.
↑ Mohr, Peter J.; Taylor, Barry N.; Newell, David B. (2008). «CODATA Recommended Values of the Fundamental Physical Constants: 2006». Reviews of Modern Physics 80: 633-730. doi:10.1103/RevModPhys.80.633.
↑ P.J. Mohr, B.N. Taylor, y D.B. Newell (2011), "The 2010 CODATA Recommended Values of the Fundamental Physical Constants" (Versión web 6.0). Este artículo fue desarrollado por J. Baker, M. Douma, y S. Kotochigova. Disponible: http://physics.nist.gov/constants [Jueves, 02-Jun-2011 21:00:12 EDT]. National Institute of Standards and Technology, Gaithersburg, MD 20899.
↑ «JERRY COFF». Consultado el 10 de septiembre de 2010.
↑ ab
«CODATA value: proton-electron mass ratio». 2006 CODATA recommended values. National Institute of Standards and Technology. Consultado el 18 de julio de 2009.
↑ abc
Curtis, L.J. (2003). Atomic Structure and Lifetimes: A Conceptual Approach. Cambridge University Press. p. 74. ISBN 0-521-53635-9.
↑
Anastopoulos, C. (2008). Particle Or Wave: The Evolution of the Concept of Matter in Modern Physics. Princeton University Press. pp. 236-237. ISBN 0-691-13512-6.
↑ abc Dahl (1997:122–185).
↑ ab
Wilson, R. (1997). Astronomy Through the Ages: The Story of the Human Attempt to Understand the Universe. CRC Press. p. 138. ISBN 0-7484-0748-0.
↑ ab
Pauling, L. C. (1960). The Nature of the Chemical Bond and the Structure of Molecules and Crystals: an introduction to modern structural chemistry (3rd edición). Cornell University Press. pp. 4-10. ISBN 0-8014-0333-2.
↑
Shipley, J.T. (2162). Dictionary of Word Origins. The Philosophical Library. p. 133. ISBN 0-88029-751-4.
↑
Baigrie, B. (2006). Electricity and Magnetism: A Historical Perspective. Greenwood Press. pp. 7-8. ISBN 0-313-33358-0.
↑
Keithley, J.F. (1999). The Story of Electrical and Magnetic Measurements: From 500 B.C. to the 1940s. IEEE Press. pp. 15, 20. ISBN 0-7803-1193-0.
↑
«Benjamin Franklin (1706–1790)». Eric Weisstein's World of Biography. Wolfram Research. Consultado el 16 de diciembre de 2010.
↑
Myers, R. L. (2006). The Basics of Physics. Greenwood Publishing Group. p. 242. ISBN 0-313-32857-9.
↑
Barrow, J. D. (1983). «Natural Units Before Planck». Quarterly Journal of the Royal Astronomical Society 24: 24-26. Bibcode:1983QJRAS..24...24B.
↑
Stoney, G. J. (1894). «Of the "Electron," or Atom of Electricity». Philosophical Magazine 38 (5): 418-420.
↑
Soukhanov, A. H. ed. (1986). Word Mysteries & Histories. Houghton Mifflin Company. p. 73. ISBN 0-395-40265-4.
↑
Guralnik, D.B. ed. (1970). Webster's New World Dictionary. Prentice Hall. p. 450.
↑ Born, M.; Blin-Stoyle, R. J.; Radcliffe, J. M. (1989). Atomic Physics. Courier Dover. p. 26. ISBN 0-486-65984-4.
↑ The Nuffield Foundation (1974). «Movimiento circular y electrones en órbitas». Física básica: guía de experimentos, volumen V. España: Reverté. p. 3. ISBN 84-291-4227-4. Consultado el 18 de enero de 2013.
↑ Dahl (1997:55–58).
↑
DeKosky, R. K. (1983). «William Crookes and the quest for absolute vacuum in the 1870s». Annals of Science 40 (1): 1-18. doi:10.1080/00033798300200101.
↑ abc
Leicester, H. M. (1971). The Historical Background of Chemistry. Courier Dover. pp. 221-222. ISBN 0-486-61053-5.
↑ Dahl (1997:64–78).
↑
Zeeman, P.; Zeeman, P. (1907). «Sir William Crookes, FRS». Nature 77 (1984): 1-3. Bibcode:1907Natur..77....1C. doi:10.1038/077001a0.
↑ Dahl (1997:99).
↑
Thomson, J.J. (1906). «Nobel Lecture: Carriers of Negative Electricity». La Fundación Nobel. Consultado el 25 de agosto de 2008.
↑
Trenn, T. J. (1976). «Rutherford on the Alpha-Beta-Gamma Classification of Radioactive Rays». Isis 67 (1): 61-75. JSTOR 231134. doi:10.1086/351545.
↑
Becquerel, H. (1900). «Déviation du Rayonnement du Radium dans un Champ Électrique». Comptes rendus de l'Académie des sciences 130: 809-815.
↑ Buchwald and Warwick (2001:90–91).
↑
Myers, W. G. (1976). «Becquerel's Discovery of Radioactivity in 1896». Journal of Nuclear Medicine 17 (7): 579-582. PMID 775027.
↑
Kikoin, I. K.; Sominskiĭ, I. S. (1961). «Abram Fedorovich Ioffe (on his eightieth birthday)». Soviet Physics Uspekhi 3 (5): 798-809. Bibcode:1961SvPhU...3..798K. doi:10.1070/PU1961v003n05ABEH005812. Original publication in Russian: Кикоин, И. К.; Соминский, М. С. (1960). «Академик А.Ф. Иоффе». Успехи Физических Наук 72 (10): 303-321.
↑
Millikan, R. A. (1911). «The Isolation of an Ion, a Precision Measurement of its Charge, and the Correction of Stokes' Law». Physical Review 32 (2): 349-397. Bibcode:1911PhRvI..32..349M. doi:10.1103/PhysRevSeriesI.32.349.
↑ Das Gupta, N. N.; Ghosh, S. K. (1999). «A Report on the Wilson Cloud Chamber and Its Applications in Physics». Reviews of Modern Physics 18 (2): 225-290. Bibcode:1946RvMP...18..225G. doi:10.1103/RevModPhys.18.225.
↑ abc
Smirnov, B. M. (2003). Physics of Atoms and Ions. Springer. pp. 14-21. ISBN 0-387-95550-X.
↑
Bohr, N. (1922). «Nobel Lecture: The Structure of the Atom». La Fundación Nobel. Consultado el 3 de diciembre de 2008.
↑
Lewis, G. N. (1916). «The Atom and the Molecule». Journal of the American Chemical Society 38 (4): 762-786. doi:10.1021/ja02261a002.
↑
Arabatzis, T.; Gavroglu, K. (1997). «The Chemists' Electron». European Journal of Physics 18 (3): 150-163. Bibcode:1997EJPh...18..150A. doi:10.1088/0143-0807/18/3/005.
↑
Langmuir, I. (1919). «The Arrangement of Electrons in Atoms and Molecules». Journal of the American Chemical Society 41 (6): 868-934. doi:10.1021/ja02227a002.
↑
Scerri, E. R. (2007). The Periodic Table. Oxford University Press. pp. 205-226. ISBN 0-19-530573-6.
↑
Massimi, M. (2005). Pauli's Exclusion Principle, The Origin and Validation of a Scientific Principle. Cambridge University Press. pp. 7-8. ISBN 0-521-83911-4.
↑
Uhlenbeck, G. E.; Goudsmith, S. (1925). «Ersetzung der Hypothese vom unmechanischen Zwang durch eine Forderung bezüglich des inneren Verhaltens jedes einzelnen Elektrons». Die Naturwissenschaften 13 (47): 953. Bibcode:1925NW.....13..953E. doi:10.1007/BF01558878.
↑
Pauli, W. (1923). «Über die Gesetzmäßigkeiten des anomalen Zeemaneffektes». Zeitschrift für Physik 16 (1): 155-164. Bibcode:1923ZPhy...16..155P. doi:10.1007/BF01327386.
↑ ab
de Broglie, L. (1929). «Nobel Lecture: The Wave Nature of the Electron». La Fundación Nobel. Consultado el 30 de agosto de 2008.
↑
Falkenburg, B. (2007). Particle Metaphysics: A Critical Account of Subatomic Reality. Springer. p. 85. ISBN 3-540-33731-8.
↑
Davisson, C. (1937). «Nobel Lecture: The Discovery of Electron Waves». La Fundación Nobel. Consultado el 30 de agosto de 2008.
↑
Schrödinger, E. (1926). «Quantisierung als Eigenwertproblem». Annalen der Physik 385 (13): 437-490. Bibcode:1926AnP...385..437S. doi:10.1002/andp.19263851302.
↑
Rigden, J. S. (2003). Hydrogen. Harvard University Press. pp. 59-86. ISBN 0-674-01252-6.
↑
Reed, B. C. (2007). Quantum Mechanics. Jones & Bartlett Publishers. pp. 275-350. ISBN 0-7637-4451-4.
↑
Dirac, P. A. M. (1928). The Quantum Theory of the Electron 117 (778). pp. 610-624. Bibcode:1928RSPSA.117..610D. doi:10.1098/rspa.1928.0023.
↑
Dirac, P. A. M. (1933). «Nobel Lecture: Theory of Electrons and Positrons». La Fundación Nobel. Consultado el 1 de noviembre de 2008.
↑
«The Nobel Prize in Physics 1965». La Fundación Nobel. Consultado el 4 de noviembre de 2008.
↑
Panofsky, W. K. H. (1997). «The Evolution of Particle Accelerators & Colliders». Beam Line (Stanford University) 27 (1): 36-44. Consultado el 15 de septiembre de 2008.
↑
Elder, F. R.; et al. (1947). «Radiation from Electrons in a Synchrotron». Physical Review 71 (11): 829-830. Bibcode:1947PhRv...71..829E. doi:10.1103/PhysRev.71.829.5. La referencia utiliza el parámetro obsoleto|coauthor=(ayuda)
↑
Hoddeson, L.; et al. (1997). The Rise of the Standard Model: Particle Physics in the 1960s and 1970s. Cambridge University Press. pp. 25-26. ISBN 0-521-57816-7. La referencia utiliza el parámetro obsoleto|coauthor=(ayuda)
↑
Bernardini, C. (2004). «AdA: The First Electron–Positron Collider». Physics in Perspective 6 (2): 156-183. Bibcode:2004PhP.....6..156B. doi:10.1007/s00016-003-0202-y.
↑
«Testing the Standard Model: The LEP experiments». CERN. 2008. Consultado el 15 de septiembre de 2008.
↑
«LEP reaps a final harvest». CERN Courier 40 (10). 2000. Consultado el 1 de noviembre de 2008.
↑ Prati, E.; De Michielis, M.; Belli, M.; Cocco, S.; Fanciulli, M.; Kotekar-Patil, D.; Ruoff, M.; Kern, D. P. et al. (2012). «Few electron limit of n-type metal oxide semiconductor single electron transistors». Nanotechnology 23 (21): 215204. PMID 22552118. doi:10.1088/0957-4484/23/21/215204. Se sugiere usar|número-autores=(ayuda)
↑
Frampton, P. H.; Hung, P. Q.; Sher, Marc (2000). «Quarks and Leptons Beyond the Third Generation». Physics Reports 330 (5-6): 263-348. Bibcode:2000PhR...330..263F. arXiv:hep-ph/9903387. doi:10.1016/S0370-1573(99)00095-2.
↑ abc
Raith, W.; Mulvey, T. (2001). Constituents of Matter: Atoms, Molecules, Nuclei and Particles. CRC Press. pp. 777-781. ISBN 0-8493-1202-7.
↑ abcdefgh La fuente principal para el CODATA es Mohr, P. J.; Taylor, B. N.; Newell, D. B. (2006). «CODATA recommended values of the fundamental physical constants». Reviews of Modern Physics 80 (2): 633-730. Bibcode:2008RvMP...80..633M. arXiv:0801.0028. doi:10.1103/RevModPhys.80.633.
- Las constantes físicas individuales del CODATA se encuentran disponibles en: «The NIST Reference on Constants, Units and Uncertainty». National Institute of Standards and Technology. Consultado el 15 de enero de 2009.
- Las constantes físicas individuales del CODATA se encuentran disponibles en: «The NIST Reference on Constants, Units and Uncertainty». National Institute of Standards and Technology. Consultado el 15 de enero de 2009.
↑
Zombeck, M. V. (2007). Handbook of Space Astronomy and Astrophysics (3rd edición). Cambridge University Press. p. 14. ISBN 0-521-78242-2.
↑
Murphy, M. T.; et al. (2008). «Strong Limit on a Variable Proton-to-Electron Mass Ratio from Molecules in the Distant Universe». Science 320 (5883): 1611-1613. Bibcode:2008Sci...320.1611M. PMID 18566280. arXiv:0806.3081. doi:10.1126/science.1156352. La referencia utiliza el parámetro obsoleto|coauthor=(ayuda)
↑
Zorn, J. C.; Chamberlain, G. E.; Hughes, V. W. (1963). «Experimental Limits for the Electron-Proton Charge Difference and for the Charge of the Neutron». Physical Review 129 (6): 2566-2576. Bibcode:1963PhRv..129.2566Z. doi:10.1103/PhysRev.129.2566.
↑ ab
Odom, B.; et al. (2006). «New Measurement of the Electron Magnetic Moment Using a One-Electron Quantum Cyclotron». Physical Review Letters 97 (3): 030801. Bibcode:2006PhRvL..97c0801O. PMID 16907490. doi:10.1103/PhysRevLett.97.030801. La referencia utiliza el parámetro obsoleto|coauthor=(ayuda)
↑
Anastopoulos, C. (2008). Particle Or Wave: The Evolution of the Concept of Matter in Modern Physics. Princeton University Press. pp. 261-262. ISBN 0-691-13512-6.
↑
Meschede, D. (2004). Optics, light and lasers: The Practical Approach to Modern Aspects of Photonics and Laser Physics. Wiley-VCH. p. 168. ISBN 3-527-40364-7.
↑
Steinberg, R.I.; et al. (1999). «Experimental test of charge conservation and the stability of the electron». Physical Review D 61 (2): 2582-2586. Bibcode:1975PhRvD..12.2582S. doi:10.1103/PhysRevD.12.2582. La referencia utiliza el parámetro obsoleto|coauthor=(ayuda)
↑
J. Beringer et al.(Particle Data Group) (2012, 86, 010001 (2012)). «Review of Particle Physics: [electron properties]». Physical Review D 86 (1): 010001.
↑
Back, H. O.; et al. (2002). «Search for electron decay mode e → γ + ν with prototype of Borexino detector». Physics Letters B 525: 29-40. Bibcode:2002PhLB..525...29B. doi:10.1016/S0370-2693(01)01440-X. La referencia utiliza el parámetro obsoleto|coauthor=(ayuda)
↑ abc
Munowitz, M. (2005). Knowing, The Nature of Physical Law. Oxford University Press. pp. 162-218. ISBN 0-19-516737-6.
↑
Kane, G. (9 de octubre de 2006). «Are virtual particles really constantly popping in and out of existence? Or are they merely a mathematical bookkeeping device for quantum mechanics?». Scientific American. Consultado el 19 de septiembre de 2008.
↑
Taylor, J. (1989). «Gauge Theories in Particle Physics». En Davies, Paul. The New Physics. Cambridge University Press. p. 464. ISBN 0-521-43831-4.
↑ ab
Genz, H. (2001). Nothingness: The Science of Empty Space. Da Capo Press. pp. 241-243, 245-247. ISBN 0-7382-0610-5.
↑
Gribbin, J. (25 de enero de 1997). «More to electrons than meets the eye». New Scientist. Consultado el 17 de septiembre de 2008.
↑
Levine, I.; et al. (1997). «Measurement of the Electromagnetic Coupling at Large Momentum Transfer». Physical Review Letters 78 (3): 424-427. Bibcode:1997PhRvL..78..424L. doi:10.1103/PhysRevLett.78.424. La referencia utiliza el parámetro obsoleto|coauthor=(ayuda)
↑
Murayama, H. (10-17 de marzo de 2006). «Supersymmetry Breaking Made Easy, Viable and Generic». Proceedings of the XLIInd Rencontres de Moriond on Electroweak Interactions and Unified Theories. La Thuile, Italy. arXiv:0709.3041. .
↑
Schwinger, J. (1948). «On Quantum-Electrodynamics and the Magnetic Moment of the Electron». Physical Review 73 (4): 416-417. Bibcode:1948PhRv...73..416S. doi:10.1103/PhysRev.73.416.
↑
Huang, K. (2007). Fundamental Forces of Nature: The Story of Gauge Fields. World Scientific. pp. 123-125. ISBN 981-270-645-3.
↑
Foldy, L. L.; Wouthuysen, S. (1950). «On the Dirac Theory of Spin 1/2 Particles and Its Non-Relativistic Limit». Physical Review 78: 29-36. Bibcode:1950PhRv...78...29F. doi:10.1103/PhysRev.78.29.
↑
Sidharth, B. G. (2008). «Revisiting Zitterbewegung». International Journal of Theoretical Physics 48 (2): 497-506. Bibcode:2009IJTP...48..497S. arXiv:0806.0985. doi:10.1007/s10773-008-9825-8.
↑
Elliott, R. S. (1978). «The History of Electromagnetics as Hertz Would Have Known It». IEEE Transactions on Microwave Theory and Techniques 36 (5): 806-823. Bibcode:1988ITMTT..36..806E. doi:10.1109/22.3600.
↑ Munowitz (2005:140).
↑
Crowell, B. (2000). Electricity and Magnetism. Light and Matter. pp. 129-152. ISBN 0-9704670-4-4.
↑ Munowitz (2005:160).
↑
Mahadevan, R.; Narayan, R.; Yi, I. (1996). «Harmony in Electrons: Cyclotron and Synchrotron Emission by Thermal Electrons in a Magnetic Field». The Astrophysical Journal 465: 327-337. Bibcode:1996ApJ...465..327M. arXiv:astro-ph/9601073. doi:10.1086/177422.
↑
Rohrlich, F. (1999). «The Self-Force and Radiation Reaction». American Journal of Physics 68 (12): 1109-1112. Bibcode:2000AmJPh..68.1109R. doi:10.1119/1.1286430.
↑
Georgi, H. (1989). «Grand Unified Theories». En Davies, Paul. The New Physics. Cambridge University Press. p. 427. ISBN 0-521-43831-4.
↑
Blumenthal, G. J.; Gould, R. (1970). «Bremsstrahlung, Synchrotron Radiation, and Compton Scattering of High-Energy Electrons Traversing Dilute Gases». Reviews of Modern Physics 42 (2): 237-270. Bibcode:1970RvMP...42..237B. doi:10.1103/RevModPhys.42.237.
↑
Staff (2008). «The Nobel Prize in Physics 1927». La Fundación Nobel. Consultado el 28 de septiembre de 2008.
↑
Chen, S.-Y.; Maksimchuk, A.; Umstadter, D. (1998). «Experimental observation of relativistic nonlinear Thomson scattering». Nature 396 (6712): 653-655. Bibcode:1998Natur.396..653C. arXiv:physics/9810036. doi:10.1038/25303.
↑
Beringer, R.; Montgomery, C. G. (1942). «The Angular Distribution of Positron Annihilation Radiation». Physical Review 61 (5-6): 222-224. Bibcode:1942PhRv...61..222B. doi:10.1103/PhysRev.61.222.
↑
Buffa, A. (2000). College Physics (4th edición). Prentice Hall. p. 888. ISBN 0-13-082444-5.
↑
Eichler, J. (2005). «Electron–positron pair production in relativistic ion–atom collisions». Physics Letters A 347 (1-3): 67-72. Bibcode:2005PhLA..347...67E. doi:10.1016/j.physleta.2005.06.105.
↑
Hubbell, J. H. (2006). «Electron positron pair production by photons: A historical overview». Radiation Physics and Chemistry 75 (6): 614-623. Bibcode:2006RaPC...75..614H. doi:10.1016/j.radphyschem.2005.10.008.
↑
Quigg, C. (4-30 de junio de 2000). «The Electroweak Theory». TASI 2000: Flavor Physics for the Millennium. Boulder, Colorado. p. 80. arXiv:hep-ph/0204104.
↑
Mulliken, R. S. (1967). «Spectroscopy, Molecular Orbitals, and Chemical Bonding». Science 157 (3784): 13-24. Bibcode:1967Sci...157...13M. PMID 5338306. doi:10.1126/science.157.3784.13.
↑
Burhop, E. H. S. (1952). The Auger Effect and Other Radiationless Transitions. Cambridge University Press. pp. 2-3. ISBN 0-88275-966-3.
↑ ab
Grupen, C. (2000). «Physics of Particle Detection». AIP Conference Proceedings 536: 3-34. arXiv:physics/9906063. doi:10.1063/1.1361756.
↑
Jiles, D. (1998). Introduction to Magnetism and Magnetic Materials. CRC Press. pp. 280-287. ISBN 0-412-79860-3.
↑
Löwdin, P. O.; Erkki Brändas, E.; Kryachko, E. S. (2003). Fundamental World of Quantum Chemistry: A Tribute to the Memory of Per- Olov Löwdin. Springer. pp. 393-394. ISBN 1-4020-1290-X.
↑
McQuarrie, D. A.; Simon, J. D. (1997). Physical Chemistry: A Molecular Approach. University Science Books. pp. 325-361. ISBN 0-935702-99-7.
↑
Daudel, R.; et al. (1973). «The Electron Pair in Chemistry». Canadian Journal of Chemistry 52 (8): 1310-1320. doi:10.1139/v74-201. La referencia utiliza el parámetro obsoleto|coauthor=(ayuda) (enlace roto disponible en Internet Archive; véase el historial y la última versión).
↑
Rakov, V. A.; Uman, M. A. (2007). Lightning: Physics and Effects. Cambridge University Press. p. 4. ISBN 0-521-03541-4.
↑
Freeman, G. R. (1999). «Triboelectricity and some associated phenomena». Materials Science and Technology 15 (12): 1454-1458.
↑
Forward, K. M.; Lacks, D. J.; Sankaran, R. M. (2009). «Methodology for studying particle–particle triboelectrification in granular materials». Journal of Electrostatics 67 (2-3): 178-183. doi:10.1016/j.elstat.2008.12.002.
↑
Weinberg, S. (2003). The Discovery of Subatomic Particles. Cambridge University Press. pp. 15-16. ISBN 0-521-82351-X.
↑
Lou, L.-F. (2003). Introduction to phonons and electrons. World Scientific. pp. 162, 164. ISBN 978-981-238-461-4.
↑
Guru, B.S.; Hızıroğlu, H.R. (2004). Electromagnetic Field Theory. Cambridge University Press. pp. 138, 276. ISBN 0-521-83016-8.
↑
Achuthan, M. K.; Bhat, K. N. (2007). Fundamentals of Semiconductor Devices. Tata McGraw-Hill. pp. 49-67. ISBN 0-07-061220-X.
↑ ab
Ziman, J. M. (2001). Electrons and Phonons: The Theory of Transport Phenomena in Solids. Oxford University Press. p. 260. ISBN 0-19-850779-8.
↑
Main, P. (12 de junio de 1993). «When electrons go with the flow: Remove the obstacles that create electrical resistance, and you get ballistic electrons and a quantum surprise». New Scientist 1887: 30. Consultado el 9 de octubre de 2008.
↑
Blackwell, G. R. (2000). The Electronic Packaging Handbook. CRC Press. pp. 6.39-6.40. ISBN 0-8493-8591-1.
↑
Durrant, A. (2000). Quantum Physics of Matter: The Physical World. CRC Press. pp. 43, 71-78. ISBN 0-7503-0721-8.
↑
Staff (2008). «The Nobel Prize in Physics 1972». La Fundación Nobel. Consultado el 13 de octubre de 2008.
↑
Kadin, A. M. (2007). «Spatial Structure of the Cooper Pair». Journal of Superconductivity and Novel Magnetism 20 (4): 285-292. arXiv:cond-mat/0510279. doi:10.1007/s10948-006-0198-z.
↑
«Discovery About Behavior Of Building Block Of Nature Could Lead To Computer Revolution». ScienceDaily. 31 de julio de 2009. Consultado el 1 de agosto de 2009.
↑
Jompol, Y.; et al. (2009). «Probing Spin-Charge Separation in a Tomonaga-Luttinger Liquid». Science 325 (5940): 597-601. Bibcode:2009Sci...325..597J. PMID 19644117. arXiv:1002.2782. doi:10.1126/science.1171769. La referencia utiliza el parámetro obsoleto|coauthor=(ayuda)
↑
Staff (2008). «The Nobel Prize in Physics 1958, for the discovery and the interpretation of the Cherenkov effect». La Fundación Nobel. Consultado el 25 de septiembre de 2008.
↑
Staff (26 de agosto de 2008). «Special Relativity». Stanford Linear Accelerator Center. Consultado el 25 de septiembre de 2008.
↑
Adams, S. (2000). Frontiers: Twentieth Century Physics. CRC Press. p. 215. ISBN 0-7484-0840-1.
↑
Lurquin, P.F. (2003). The Origins of Life and the Universe. Columbia University Press. p. 2. ISBN 0-231-12655-7.
↑
Silk, J. (2000). The Big Bang: The Creation and Evolution of the Universe (3ra edición). Macmillan. pp. 110-112, 134-137. ISBN 0-8050-7256-X.
↑
Christianto, V. (2007). «Thirty Unsolved Problems in the Physics of Elementary Particles» (pdf). Progress in Physics 4: 112-114. Archivado desde el original el 10 de septiembre de 2008.
↑
Kolb, E. W. (1980). «The Development of Baryon Asymmetry in the Early Universe». Physics Letters B 91 (2): 217-221. Bibcode:1980PhLB...91..217K. doi:10.1016/0370-2693(80)90435-9.
↑
Sather, E. (Spring/Summer 1996). «The Mystery of Matter Asymmetry». Beam Line. University of Stanford. Consultado el 1 de noviembre de 2008.
↑
Burles, S.; Nollett, K.M.; Turner, M.S. (1999). «Big-Bang Nucleosynthesis: Linking Inner Space and Outer Space».
.
↑ Boesgaard, A. M.; Steigman, G. (1985). «Big bang nucleosynthesis – Theories and observations». Annual Review of Astronomy and Astrophysics 23 (2): 319-378. Bibcode:1985ARA&A..23..319B. doi:10.1146/annurev.aa.23.090185.001535.
↑ ab
Barkana, R. (2006). «The First Stars in the Universe and Cosmic Reionization». Science 313 (5789): 931-934. Bibcode:2006Sci...313..931B. PMID 16917052. arXiv:astro-ph/0608450. doi:10.1126/science.1125644.
↑
Burbidge, E. M.; et al. (1957). «Synthesis of Elements in Stars». Reviews of Modern Physics 29 (4): 548-647. Bibcode:1957RvMP...29..547B. doi:10.1103/RevModPhys.29.547. La referencia utiliza el parámetro obsoleto|coauthor=(ayuda)
↑
Rodberg, L. S.; Weisskopf, V. (1957). «Fall of Parity: Recent Discoveries Related to Symmetry of Laws of Nature». Science 125 (3249): 627-633. Bibcode:1957Sci...125..627R. PMID 17810563. doi:10.1126/science.125.3249.627.
↑
Fryer, C. L. (1999). «Mass Limits For Black Hole Formation». The Astrophysical Journal 522 (1): 413-418. Bibcode:1999ApJ...522..413F. arXiv:astro-ph/9902315. doi:10.1086/307647.
↑
Parikh, M. K.; Wilczek, F. (2000). «Hawking Radiation As Tunneling». Physical Review Letters 85 (24): 5042-5045. Bibcode:2000PhRvL..85.5042P. PMID 11102182. arXiv:hep-th/9907001. doi:10.1103/PhysRevLett.85.5042.
↑
Hawking, S. W. (1974). «Black hole explosions?». Nature 248 (5443): 30-31. Bibcode:1974Natur.248...30H. doi:10.1038/248030a0.
↑
Halzen, F.; Hooper, D. (2002). «High-energy neutrino astronomy: the cosmic ray connection». Reports on Progress in Physics 66 (7): 1025-1078. Bibcode:2002astro.ph..4527H. arXiv:astro-ph/0204527. doi:10.1088/0034-4885/65/7/201.
↑
Ziegler, J. F. (1998). «Terrestrial cosmic ray intensities». IBM Journal of Research and Development 42 (1): 117-139. doi:10.1147/rd.421.0117.
↑
Sutton, C. (4 de agosto de 1990). «Muons, pions and other strange particles». New Scientist. Consultado el 28 de agosto de 2008.
↑
Wolpert, S. (24 de julio de 2008). «Scientists solve 30-year-old aurora borealis mystery». Universidad of California. Archivado desde el original el 17 de agosto de 2008. Consultado el 11 de octubre de 2008.
↑
Gurnett, D. A.; Anderson, R. (1976). «Electron Plasma Oscillations Associated with Type III Radio Bursts». Science 194 (4270): 1159-1162. Bibcode:1976Sci...194.1159G. PMID 17790910. doi:10.1126/science.194.4270.1159.
↑
Martin, W.C.; Wiese, W.L. (2007). «Atomic Spectroscopy: A Compendium of Basic Ideas, Notation, Data, and Formulas». National Institute of Standards and Technology. Consultado el 8 de enero de 2007.
↑
Fowles, G. R. (1990). Introduction to Modern Optics. Courier Dover. pp. 227-233. ISBN 0-486-65957-7.
↑
Staff (2008). «The Nobel Prize in Physics 1989». La Fundación Nobel. Consultado el 24 de septiembre de 2008.
↑
Ekstrom, P. (1980). «The isolated Electron». Scientific American 243 (2): 91-101. Consultado el 24 de septiembre de 2008.
↑
Mauritsson, J. «Electron filmed for the first time ever». Lund University. Archivado desde el original el 25 de marzo de 2009. Consultado el 17 de septiembre de 2008.
↑
Mauritsson, J.; et al. (2008). «Coherent Electron Scattering Captured by an Attosecond Quantum Stroboscope». Physical Review Letters 100 (7): 073003. Bibcode:2008PhRvL.100g3003M. PMID 18352546. arXiv:0708.1060. doi:10.1103/PhysRevLett.100.073003. La referencia utiliza el parámetro obsoleto|coauthor=(ayuda) (enlace roto disponible en Internet Archive; véase el historial y la última versión).
↑
Damascelli, A. (2004). «Probing the Electronic Structure of Complex Systems by ARPES». Physica Scripta T109: 61-74. Bibcode:2004PhST..109...61D. arXiv:cond-mat/0307085. doi:10.1238/Physica.Topical.109a00061.
↑
Staff (4 de abril de 1975). «Image # L-1975-02972». Langley Research Center, NASA. Archivado desde el original el 7 de diciembre de 2008. Consultado el 20 de septiembre de 2008.
↑
Elmer, J. (3 de marzo de 2008). «Standardizing the Art of Electron-Beam Welding». Lawrence Livermore National Laboratory. Consultado el 16 de octubre de 2008.
↑
Schultz, H. (1993). Electron Beam Welding. Woodhead Publishing. pp. 2-3. ISBN 1-85573-050-2.
↑
Benedict, G.F. (1987). Nontraditional Manufacturing Processes. Manufacturing engineering and materials processing 19. CRC Press. p. 273. ISBN 0-8247-7352-7.
↑
Ozdemir, F. S. (25-27 de junio de 1979). «Electron beam lithography». Proceedings of the 16th Conference on Design automation. San Diego, CA, USA: IEEE Press. pp. 383-391. Consultado el 16 de octubre de 2008.
↑
Madou, M. J. (2002). Fundamentals of Microfabrication: the Science of Miniaturization (2da edición). CRC Press. pp. 53-54. ISBN 0-8493-0826-7.
↑
Jongen, Y.; Herer, A. (2-5 de mayo de 1996). «Electron Beam Scanning in Industrial Applications». APS/AAPT Joint Meeting. American Physical Society. Bibcode:1996APS..MAY.H9902J.
↑
Beddar, A. S. (2001). «Mobile linear accelerators for intraoperative radiation therapy». AORN Journal 74 (5): 700. doi:10.1016/S0001-2092(06)61769-9. Consultado el 26 de octubre de 2008.
↑
Gazda, M. J.; Coia, L. R. (1 de junio de 2007). «Principles of Radiation Therapy». Cancer Network. Consultado el 26 de octubre de 2008.
↑ Chao, A. W.; Tigner, M. (1999). Handbook of Accelerator Physics and Engineering. World Scientific. pp. 155, 188. ISBN 981-02-3500-3.
↑
Oura, K.; et al. (2003). Surface Science: An Introduction. Springer. pp. 1-45. ISBN 3-540-00545-5. La referencia utiliza el parámetro obsoleto|coauthor=(ayuda)
↑
Ichimiya, A.; Cohen, P. I. (2004). Reflection High-energy Electron Diffraction. Cambridge University Press. p. 1. ISBN 0-521-45373-9.
↑
Heppell, T. A. (1967). «A combined low energy and reflection high energy electron diffraction apparatus». Journal of Scientific Instruments 44 (9): 686-688. Bibcode:1967JScI...44..686H. doi:10.1088/0950-7671/44/9/311.
↑
McMullan, D. (1993). «Scanning Electron Microscopy: 1928–1965». University of Cambridge. Consultado el 23 de marzo de 2009.
↑
Slayter, H. S. (1992). Light and electron microscopy. Cambridge University Press. p. 1. ISBN 0-521-33948-0.
↑
Cember, H. (1996). Introduction to Health Physics. McGraw-Hill Professional. pp. 42-43. ISBN 0-07-105461-8.
↑
Erni, R.; et al. (2009). «Atomic-Resolution Imaging with a Sub-50-pm Electron Probe». Physical Review Letters 102 (9): 096101. Bibcode:2009PhRvL.102i6101E. PMID 19392535. doi:10.1103/PhysRevLett.102.096101. La referencia utiliza el parámetro obsoleto|coauthor=(ayuda)
↑
Bozzola, J. J.; Russell, L. D. (1999). Electron Microscopy: Principles and Techniques for Biologists. Jones & Bartlett Publishers. pp. 12, 197-199. ISBN 0-7637-0192-0.
↑
Flegler, S. L.; Heckman Jr., J. W.; Klomparens, K. L. (1995). Scanning and Transmission Electron Microscopy: An Introduction (Reprint edición). Oxford University Press. pp. 43-45. ISBN 0-19-510751-9.
↑
Bozzola, J. J.; Russell, L. D. (1999). Electron Microscopy: Principles and Techniques for Biologists (2da edición). Jones & Bartlett Publishers. p. 9. ISBN 0-7637-0192-0.
↑
Freund, H. P.; Antonsen, T. (1996). Principles of Free-Electron Lasers. Springer. pp. 1-30. ISBN 0-412-72540-1.
↑
Kitzmiller, J. W. (1995). Television Picture Tubes and Other Cathode-Ray Tubes: Industry and Trade Summary. DIANE Publishing. pp. 3-5. ISBN 0-7881-2100-6.
↑
Sclater, N. (1999). Electronic Technology Handbook. McGraw-Hill Professional. pp. 227-228. ISBN 0-07-058048-0.
↑
Staff (2008). «The History of the Integrated Circuit». La Fundación Nobel. Consultado el 18 de octubre de 2008.
Enlaces externos
 Wikisource en inglés contiene el artículo de la Encyclopædia Britannica de 1911 sobre Electrón.
Wikisource en inglés contiene el artículo de la Encyclopædia Britannica de 1911 sobre Electrón.
 Wikimedia Commons alberga una categoría multimedia sobre Electrón.
Wikimedia Commons alberga una categoría multimedia sobre Electrón.
«The Discovery of the Electron». American Institute of Physics, Centro para la Historia de la Física.
«Particle Data Group». University of California.
Bock, R.K.; Vasilescu, A. (1998). The Particle Detector BriefBook (14ta edición). Springer. ISBN 3-540-64120-3.
Copeland, Ed. «Spherical Electron». Sixty Symbols. Brady Haran para la Universidad de Nottingham.






