Cobalto
Hierro ← Cobalto → Níquel | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Metálico con tono gris  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Nombre, símbolo, número | Cobalto, Co, 27 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Metales de transición | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Grupo, período, bloque | 9, 4, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 58,933200 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Ar]3d74s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Mohs | 4,0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Electrones por nivel | 2, 8, 15, 2 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | 135 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1.88 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Radio atómico (calc) | 152 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 126 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | 5, 4 , 3, 2, 1, -1 (anfótero) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª Energía de ionización | 760,4 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª Energía de ionización | 1648 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.ª Energía de ionización | 3232 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4.ª Energía de ionización | 4950 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Sólido (ferromagnético) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 8900 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 1768 K (1495 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 3200 K (2927 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 376,5 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 16,19 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor | 175 Pa a 1768 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | Hexagonal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N° CAS | 7440-48-4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N° EINECS | 231-158-0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 420 J/(K·kg) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 100 W/(K·m) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | 4720 m/s a 293,15 K (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Artículo principal: Isótopos del cobalto | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
[editar datos en Wikidata] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El cobalto (del alemán kobalt, voz derivada de kobolds, los "gnomos" que, según los mineros de Sajonia de la Edad Media, eran espíritus de la tierra que tenían embrujado el mineral, por lo que, aunque parecía mena de cobre, no producía este elemento con el tratamiento habitual[1]) es un elemento químico de número atómico 27 y símbolo Co situado en el grupo 9 de la tabla periódica de los elementos.[2][3]
Índice
1 Etimología
2 Características principales
3 Historia
4 Producción
5 Aplicaciones
6 Compuestos
7 Isótopos
8 Función biológica
9 Precauciones
10 Véase también
11 Referencias
12 Enlaces externos
Etimología
Se le denominaba kobold en la Edad Media por los mineros que consideraban este metal sin valor y tenían la creencia de que un buen duende (un kobold) lo ponía en sustitución de la plata que había robado.[4] En el diccionario castellano del siglo XVIII aparece como cobalt.
Características principales

Cobalto puro
El cobalto es un metal ferromagnético, de color blanco azulado. Su temperatura de Curie es de 1388 K. Normalmente se encuentra junto con níquel, y ambos suelen formar parte de los meteoritos de hierro. Es un elemento químico esencial para los mamíferos en pequeñas cantidades. El Co-60, un radioisótopo de cobalto, es un importante trazador y agente en el tratamiento del cáncer.
El cobalto metálico está comúnmente constituido de una mezcla de dos formas alotrópicas con estructuras cristalinas hexagonal y cúbica centrada en las caras siendo la temperatura de transición entre ambas de 722 K.
Se emplea sobre todo en superaleaciones de alto rendimiento, siendo éstas normalmente más caras que las de níquel. Es un metal eminentemente de aleación, al igual que el níquel o el zinc, por ejemplo. Dichos metales suelen agregarse a otros que actúan de base, aunque cuando el Cobalto actúa de base suele hacerlo en aleaciones con cromo. Su principal característica es su elevadísima dureza y resistencia al desgaste. Son aleaciones normalmente poco usadas ya que su virtud no compensa la gran cantidad que hay que abonar por ellas. El cobalto posee características muy similares a sus elementos vecinos, hierro y níquel, con los cuales comparte más rasgos que con los elementos de su propio grupo en la tabla periódica.
Ni cobalto ni níquel suelen mezclarse con la plata ni el mercurio (siendo ambos raras excepciones) además de que comparten el efecto magnético del hierro. El cobalto es el metal más escaso de estos tres, es el menos rentable y también el más caro. Encuentra pocos usos en la industria en comparación a sus vecinos inmediatos. Se trata de uno de los pocos elementos químicos monoisotópicos. El cobalto tiene poca resistencia química aunque es más estable que el hierro ya que se mantiene en aire y agua siempre que no se encuentren otros elementos corrosivos en dichos medios.
Presenta estados de oxidación bajos. Los compuestos en los que el cobalto tiene un estado de oxidación de +4 son poco comunes. El estado de oxidación +2 es muy frecuente, así como el +3. También existen complejos importantes con el estado de oxidación +1.
Historia

Porcelana China azul y blanca, realizada sobre 1335
Los compuestos de cobalto se han utilizado durante siglos para obtener un color azul intenso de vidrio, los esmaltes y cerámicas. Se ha detectado cobalto en esculturas egipcias y en joyas persas desde el tercer milenio aC, en las ruinas de Pompeya (destruida en el año 79 dC), y en China, en la dinastía Tang (618-907 dC) y la dinastía Ming (1368-1644 dC).[5]
El cobalto se ha empleado para colorear el vidrio desde la Edad del Bronce. La excavación del naufragio Uluburun encontró un lingote de cristal azul, que fue confeccionado durante el siglo XIV AC.[6][7] artículos de cristal azul de Egipto son de color con el cobre, el hierro o el cobalto. La más antigua de cobalto de color de cristal era de la época de la dinastía XVIII de Egipto (1550-1292 aC). Se desconoce el lugar donde se obtuvieron los compuestos de cobalto.[8][9]
El elemento fue descubierto por el químico sueco George Brandt. La fecha del descubrimiento varía en las diversas fuentes entre 1730 y 1737. Mostrando que es un nuevo elemento hasta entonces desconocido diferente de bismuto y otros metales tradicionales, y decir que es un nuevo "semi-metal".[10][11] Brandt fue capaz de demostrar que el cobalto era el responsable del color azul del vidrio que previamente se atribuía al bismuto. El cobalto se convirtió en el primer metal descubierto desde la época pre-histórica, en la que todos los metales conocidos (hierro, cobre, plata, oro, zinc, mercurio, estaño, plomo y bismuto) no tenían descubridores registrados.
Su nombre proviene del alemán kobalt de kobold, llamado así por los mineros por su color, toxicidad y los problemas que ocasionaba ya que al igual que el níquel contaminaba y degradaba los elementos que se deseaba extraer. Los primeros intentos de fundición de estas menas para obtener metales como el cobre o el níquel, fracasaban dando en su lugar simplemente un polvo (óxido de cobalto (II)). Además, debido a que los minerales primarios de cobalto siempre contienen arsénico, la fundición de estas menas oxidaba el contenido de arsénico para dar el altamente tóxico y volátil, óxido de arsénico, lo que también disminuye el aprecio de estas menas para los mineros.[12]
Durante el siglo XIX, una parte significativa de la producción mundial, entre el 70 y 80%, de azul cobalto (un tinte hecho con compuestos de cobalto y alúmina) y esmalte (vidrio de cobalto en polvo para uso con fines de pigmento en cerámica y pintura) se llevó a cabo en la fábrica noruega Blaafarveværket[13][14] adquirida en 1823 por el barón W. C. Benecke y el industrial prusiano Benjamin Wegner. Las primeras minas para la producción de esmalte entre los siglos XVI al XVIII se encontraban en Noruega, Suecia, Sajonia y Hungría. Con el descubrimiento de mineral de cobalto en Nueva Caledonia en 1864 la extracción de cobalto en Europa disminuyó. Con el descubrimiento de yacimientos minerales en Ontario, Canadá en 1904 y de yacimientos aún mayores en la provincia de Katanga en el Congo en 1914, las operaciones mineras cambiaron de nuevo.[12] Por el conflicto de Shaba a partir de 1978, la principal fuente de cobalto, las minas de cobre de la provincia de Katanga, casi detuvieron su producción.[15][16] El impacto en la economía mundial de cobalto de este conflicto fue menor de lo esperado, porque la industria establecida formas efectivas para reciclar de materiales de cobalto y en algunos casos fue capaz de cambiar a alternativas sin cobalto.[15][16]
En 1938 John Livingood y Glenn Seaborg descubrieron el cobalto-60.[17] La primera máquina de radioterapia, bomba de cobalto, construida en Canadá por un equipo liderado por Ivan Smith y Roy Errington se utilizó en un paciente el 27 de octubre de 1951; el equipo se encuentra actualmente expuesto en el Saskatoon Cancer Centre, en la ciudad de Saskatoon (Saskatchewan).
Después de la Segunda Guerra Mundial, los EE. UU. quería asegurase de que nunca le faltaría el mineral de cobalto necesario, como le había ocurrido a los alemanes y fue la exploración de una fuente dentro de la frontera de los EE. UU. Un buen suministro de los minerales necesarios se encuentra en Idaho cerca del cañón Blackbird en la ladera de una montaña. La Compañía Minera Calera comenzó la producción en este lugar[18]
Producción

Mena de cobalto

Producción de las minas de cobalto en el 2005

Producción mundial
En 2005, los depósitos de cobre en la provincia de Katanga (antigua provincia de Shaba) de la República Democrática del Congo fueron el principal productor de cobalto con casi el 40% cuota mundial, según informa el Servicio Geológico Británico.[19] La situación política en el Congo influye en el precio de cobalto de manera significativa.[20]
El proyecto de la Montaña Mukondo, operado por la Central African Mining and Exploration Company (CAMEC) en Katanga, puede ser la más rica reserva de cobalto en el mundo. Se estima que será capaz de producir alrededor de un tercio de la producción total mundial de cobalto en el 2008.[21] En julio de 2009 CAMEC anunció un acuerdo a largo plazo en virtud del cual CAMEC entregaría toda su producción anual de concentrado de cobalto de la Montaña Mukondo a Zhejiang Galico Cobalt & Nickel Materials de China.[22]
Existen varios métodos para separar el cobalto del cobre y níquel. Dependen de la concentración de cobalto y la composición exacta del mineral utilizado. Una etapa de separación implica flotación por espuma, en el que los tensioactivos se unen a los diferentes componentes del mineral, dando lugar a un enriquecimiento de mena de cobalto. Tras el tostado se convierte la mena a sulfato de cobalto, mientras que el cobre y el hierro se oxida al óxido. La lixiviación con agua extrae el sulfato junto con los arseniatos. Los residuos están además lixiviado con ácido sulfúrico obteniéndose una solución de sulfato de cobre. El cobalto también puede ser lixiviado de la escoria de la fundición de cobre.[23]
Los productos de los procesos mencionados anteriormente se transforman en óxido de cobalto (Co3O4). Este óxido se reduce al metal por la reacción aluminotérmica o reducción con carbono en un alto horno.[24]
Aplicaciones
Aleaciones entre las que cabe señalar superaleaciones usadas en turbinas de gas de aviación, aleaciones resistentes a la corrosión, aceros rápidos, y carburos cementados y herramientas de diamante. Herramientas de corte en procesos de fabricación para fresadoras.
Imanes (Alnico, Fernico, Cunico, Cunife) y cintas magnéticas.
Catálisis del petróleo e industria química.- Recubrimientos metálicos por deposición electrolítica por su aspecto, dureza y resistencia a la oxidación.
- Secante para pinturas, barnices y tintas.
- Recubrimiento base de esmaltes vitrificados.
Pigmentos (cobalto azul y cobalto verde).
Electrodos de baterías eléctricas
- Cables de acero de neumáticos.
- El Co-60 se usa como fuente de radiación gamma en radioterapia, esterilización de alimentos (pasteurización fría) y radiografía industrial para el control de calidad de metales (detección de grietas).
Compuestos
Debido a los varios estados de oxidación que presenta, existe un abundante número de compuestos de cobalto. Los óxidos CoO (temperatura de Néel 291 K) y Co3O4 (temperatura de Néel 40 K) son ambos antiferromagnéticos a baja temperatura.
Isótopos
Se han caracterizado 22 radioisótopos siendo los más estables el Co-60, el Co-57 y el Co-56 con periodos de semidesintegración de 5,2714 años, 271,79 días y 70,86 días respectivamente. Los demás isótopos radiactivos tienen periodos de semidesintegración inferiores a 18 horas y la mayoría menores de 1 segundo. El cobalto presenta además cuatro metaestados, todos ellos con periodos de semidesintegración menores de 15 minutos.
La masa atómica de los isótopos del cobalto oscila entre 50 uma (Co-50) y 73 uma (Co-73). Los isótopos más ligeros que el estable (Co-59) se desintegran principalmente por captura electrónica originando isótopos de hierro, mientras que los más pesados que el isótopo estable se desintegran por emisión beta dando lugar a isótopos de níquel.
El cobalto-60 se usa en radioterapia en sustitución del radio por su menor precio (y considerando que el radio se desintegra en radon que es un elemento radiactivo y se presenta en forma de gas, por lo que es difícil encapsularlo para evitar contaminación radiactiva). Produce dos rayos gamma con energías de 1,17 MeV y 1,33 MeV y al ser la fuente empleada de unos dos centímetros de radio provoca la aparición de zonas de penumbra dispersando la radiación en torno a la dirección de radiación. El metal tiende a producir un polvo muy fino que dificulta la protección frente a la radiación. La fuente de Co-60 tiene una vida útil de aproximadamente 5 años, pero superado ese tiempo sigue siendo muy radiactivo, por lo que estas fuentes han perdido, en cierta medida, su popularidad en occidente.
Función biológica
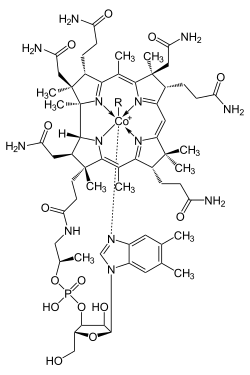
cobalamina
El cobalto es esencial en todos los animales, incluyendo los humanos. Forma parte de la cobalamina (Vitamina B12). Una deficiencia de cobalto puede llevar a anemia. Pese a ello, la anemia secundaria por déficit de cobalto es muy rara, debido a que basta con consumir trazas del elemento para mantener la correcta homeostasis. Además, el cobalto es un elemento que se encuentra en varios alimentos, siendo difícil un déficit por baja ingesta.
Las proteínas basadas en la cobalamina usan el anillo de corrina para mantener unido el cobalto. La coenzima B12 proporciona el enlace C-Co, el cual participa en las reacciones.
Precauciones
Véase también: Intoxicación por cobalto
El cobalto metálico en polvo finamente dividido es inflamable. Los compuestos de cobalto en general deben manipularse con precaución por la ligera toxicidad del metal.
El Co-60 es radiactivo y la exposición a su radiación puede provocar cáncer. La ingestión de Co-60 conlleva la acumulación de alguna cantidad en los tejidos, cantidad que se elimina muy lentamente. En una eventual confrontación nuclear, la emisión de neutrones convertiría el hierro en Co-60 multiplicando los efectos de la radiación tras la explosión y prolongando en el tiempo los efectos de la contaminación radioactiva; con este propósito se diseñan algunas armas nucleares denominadas bombas sucias (del inglés dirty bomb). En ausencia de guerra nuclear, el riesgo proviene de la inadecuada manipulación o mantenimiento de las unidades de radioterapia.
Véase también
- Cobalto-60
Referencias
↑ Asimov, I. (2014). Breve historia de la química: Introducción a las ideas y conceptos de la química. Madrid: Alianza Editorial/El Libro de Bolsillo, p. 73.
↑ Garritz, Andoni (1998). Química. Pearson Educación. p. 856. ISBN 978-9-68444-318-1.
↑ Parry, Robert W. (1973). Química: fundamentos experimentales. Reverte. p. 703. ISBN 978-8-42917-466-3.
↑ Breve diccionario etimológico de la lengua castellana, Joan Corominas, Madrid, Gredos, 1961.
↑ Cobalt, Encyclopædia Britannica Online.
↑ Pulak, Cemal (1998). «The Uluburun shipwreck: an overview». International Journal of Nautical Archaeology 27 (3): 188-224. doi:10.1111/j.1095-9270.1998.tb00803.x.
↑ Henderson, Julian (2000). «Glass». The Science and Archaeology of Materials: An Investigation of Inorganic Materials. Routledge. p. 60. ISBN 978-0-415-19933-9.
↑ Rehren, Th. (2003). «Aspects of the Production of Cobalt-blue Glass in Egypt». Archaeometry 43 (4): 483-489. doi:10.1111/1475-4754.00031.
↑ Lucas, A. (2003). Ancient Egyptian Materials and Industries. Kessinger Publishing. p. 217. ISBN 978-0-7661-5141-3.
↑ Georg Brandt first showed cobalt to be a new metal in: G. Brandt (1735) "Dissertatio de semimetallis" (Dissertation on semi-metals), Acta Literaria et Scientiarum Sveciae (Journal of Swedish literature and sciences), vol. 4, pages 1–10.
See also: (1) G. Brandt (1746) "Rön och anmärkningar angäende en synnerlig färg — cobolt" (Observations and remarks concerning an extraordinary pigment — cobalt), Kongliga Svenska vetenskapsakademiens handlingar (Transactions of the Royal Swedish Academy of Science), vol.7, pages 119–130; (2) G. Brandt (1748) “Cobalti nova species examinata et descripta” (Cobalto, a nuevo elemento examinado y descrito), Acta Regiae Societatis Scientiarum Upsaliensis (Journal of the Royal Scientific Society of Uppsala), 1st series, vol. 3 , pages 33–41; (3) James L. Marshall and Virginia R. Marshall (Spring 2003) "Rediscovery of the Elements: Riddarhyttan, Sweden," The Hexagon (official journal of the Alpha Chi Sigma fraternity of chemists), vol. 94, no. 1, pages 3–8.
↑ Wang, Shijie (2006). «Cobalt—Its recovery, recycling, and application». Journal of the Minerals, Metals and Materials Society 58 (10): 47-50. Bibcode:2006JOM....58j..47W. doi:10.1007/s11837-006-0201-y.
↑ ab Dennis, W. H (2010). «Cobalt». Metallurgy: 1863–1963. pp. 254-256. ISBN 978-0-202-36361-5.
↑ Ivar B. Ramberg (2008). The making of a land: geology of Norway. Geological Society. pp. 98-. ISBN 978-82-92394-42-7. Consultado el 30 de abril de 2011.
↑ Cyclopaedia (1852). Cyclopædia of useful arts & manufactures, ed. by C. Tomlinson. 9 divs. pp. 400-. Consultado el 30 de abril de 2011.
↑ ab Wellmer, Friedrich-Wilhelm; Becker-Platen, Jens Dieter. «Global Nonfuel Mineral Resources and Sustainability». United States Geological Survey.
↑ ab Westing, Arthur H; Stockholm International Peace Research Institute (1986). «cobalt». Global resources and international conflict: environmental factors in strategic policy and action. pp. 75-78. ISBN 978-0-19-829104-6.
↑ Livingood, J.; Seaborg, G. (1938). «Long-Lived Radio Cobalt Isotopes». Physical Review 53 (10): 847. Bibcode:1938PhRv...53..847L. doi:10.1103/PhysRev.53.847.
↑ "Richest Hole In The Mountain" Popular Mechanics, May 1952, pp. 65–69.
↑ «African Mineral Production». British Geological Survey. Consultado el 6 de junio de 2009.
↑ Wellmer, Friedrich-Wilhelm; Becker-Platen, Jens Dieter. «Global Nonfuel Mineral Resources and Sustainability». Consultado el 16 de mayo de 2009. La referencia utiliza el parámetro obsoleto|coautores=(ayuda)
↑ «CAMEC – The Cobalt Champion». International Mining. julio de 2008. Consultado el 18 de noviembre de 2011.
↑ Amy Witherden (6 de julio de 2009). «Daily podcast – July 6, 2009». Mining weekly. Consultado el 15 de noviembre de 2011.
↑ Davis, Joseph R. (2000). ASM specialty handbook: nickel, cobalt, and their alloys. ASM International. p. 347. ISBN 0-87170-685-7.
↑ Holleman, A. F., Wiberg, E., Wiberg, N. (2007). «Cobalt». Lehrbuch der Anorganischen Chemie, 102nd ed. (en alemán). de Gruyter. pp. 1146-1152. ISBN 978-3-11-017770-1.
Enlaces externos
 Wikimedia Commons alberga una galería multimedia sobre Cobalto.
Wikimedia Commons alberga una galería multimedia sobre Cobalto.- ATSDR en español - ToxFAQs™: cobalto
- Enciclopedia Libre - Cobalto
- EnvironmentalChemistry.com - Cobalto
Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química del cobalto.- Los Alamos National Laboratory - Cobalto
- WebElements.com - Cobalto
- La Química de Referencia - Cobalto
