Éster

Fórmula general de un éster.
Los ésteres son compuestos orgánicos derivados de petróleo o inorgánicos oxigenados en los cuales uno o más protones son sustituidos por grupos orgánicos alquilo (simbolizados por R').
Etimológicamente, la palabra "éster" proviene del alemán Essig-Äther (éter de vinagre), como se llamaba antiguamente al acetato de etilo.[1]
Índice
1 Descripción
2 Nomenclatura
3 Propiedades físicas
4 Propiedades químicas
5 Referencias
Descripción
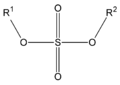
En los ésteres más comunes el ácido en cuestión es un ácido carboxílico. Por ejemplo, si el ácido es el ácido etanoico o acético, el éster es denominado como etanoato o acetato. Los ésteres también se pueden formar con ácidos inorgánicos, como el ácido carbónico (origina ésteres carbónicos), el ácido fosfórico (ésteres fosfóricos) o el ácido sulfúrico. Por ejemplo, el sulfato de dimetilo es un éster, a veces llamado "éster dimetílico del ácido sulfúrico".
| Éster (éster de ácido carboxílico) | Éster carbónico (éster de ácido carbónico) | Éster fosfórico (triéster de ácido fosfórico) | Éster sulfúrico (diéster de ácido sulfúrico) |
|---|---|---|---|
 |  |  |  |
Un ensayo recomendable para detectar ésteres es la formación de hidroxamatos férricos, fáciles de reconocer ya que son muy coloreados:
Ensayo del ácido hidroxámico: la primera etapa de la reacción es la conversión del éster en un ácido hidroxámico (catalizado por base). En el siguiente paso éste reacciona con tricloruro de hierro produciendo un hidroxamato de intenso color rojo-violeta.
En bioquímica son el producto de la reacción entre los ácidos grasos y los alcoholes.
En la formación de ésteres, cada radical -OH (grupo hidroxilo) se sustituye por la cadena -COO del ácido graso. El H sobrante del grupo carboxilo, se combina con el OH sustituido, formando agua.
En química orgánica y bioquímica los ésteres son un grupo funcional compuesto de un radical orgánico unido al residuo de cualquier ácido oxigenado (oxácido), orgánico o inorgánico. Los ésteres más comúnmente encontrados en la naturaleza son las grasas, que son ésteres de glicerina y ácidos grasos (ácido oleico, ácido esteárico, etc.)
Principalmente resultante de la condensación de un ácido carboxílico y un alcohol. El proceso se denomina esterificación. Un éster cíclico es una lactona.

Reacción de esterificación.
Nomenclatura

Etanoato de metilo.
La nomenclatura de los ésteres deriva del ácido carboxílico y el alcohol de los que procede.
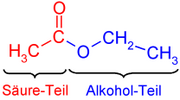
Así, en el etanoato (o acetato) de metilo encontramos dos partes en su nombre:
- La primera parte del nombre, etanoato (o acetato), proviene del ácido etanoico (acético).
- La otra mitad, de metilo, proviene del alcohol metílico (metanol).
Etanoato de etilo.
En el dibujo de la derecha se observa la parte que procede del ácido (en rojo; etanoato) y la parte que procede del alcohol (en azul, de etilo).
Luego el nombre general de un éster de ácido carboxílico será "alcanoato de alquilo" donde:
alcan-= raíz de la cadena carbonada principal (si es un alcano), que se nombra a partir del número de átomos de carbono. Por ejemplo:propan- significa cadena de 3 átomos de carbono unidos por enlaces sencillos.
oato = sufijo que indica que es derivado de un ácido carboxílico. Por ejemplo: propanoato: CH3-CH2-COO- significa "derivado del ácido propanoico".
de alquilo: Indica el alcohol de procedencia. Por ejemplo: -O-CH2-CH3 es "de etilo"
En conjunto CH3-CH2-COO-CH2-CH3 se nombra propanoato de etilo.
Para mayores detalles consulte Nomenclatura de ésteres y sales carboxílicos
Propiedades físicas
Los ésteres pueden participar en los enlaces de hidrógeno como aceptadores, pero no pueden participar como donadores en este tipo de enlaces, a diferencia de los alcoholes de los que derivan. Esta capacidad de participar en los enlaces de hidrógeno les convierte en más hidrosolubles que los hidrocarburos de los que derivan. Pero las limitaciones de sus enlaces de hidrógeno los hace más hidrofóbicos que los alcoholes o ácidos de los que derivan. Esta falta de capacidad de actuar como donador de enlace de hidrógeno ocasiona que no puedan formar enlaces de hidrógeno entre moléculas de ésteres, lo que los hace más volátiles que un ácido o alcohol de similar peso molecular.
Muchos ésteres tienen un aroma característico, lo que hace que se utilicen ampliamente como sabores y fragancias artificiales. Por ejemplo:
Acetato de 2-etilhexilo: sabor a dulzón suave
butanoato de metilo: sabor a Piña
salicilato de metilo (aceite de siempreverde o menta): aroma de las pomadas Germolene™ y Ralgex™ (Reino Unido)
octanoato de heptilo: sabor a frambuesa
etanoato de isopentilo: sabor a plátano
pentanoato de pentilo: sabor a manzana
butanoato de pentilo: sabor a pera o a albaricoque
etanoato de octilo: sabor a naranja.
Los ésteres también participan en la hidrólisis esterárica: la ruptura de un éster por agua.
Los ésteres también pueden ser descompuestos por ácidos o bases fuertes. Como resultado, se descomponen en un alcohol y un ácido carboxílico, o una sal de un ácido carboxílico:
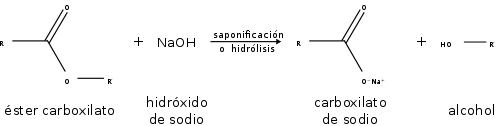
Reacción de saponificación o hidrólisis.
Propiedades químicas
En las reacciones de los ésteres, la cadena se rompe siempre en un enlace sencillo, ya sea entre el oxígeno y el alcohol o R, ya sea entre el oxígeno y el grupo R-CO-, eliminando así el alcohol o uno de sus derivados. La saponificación de los ésteres, llamada así por su analogía con la formación de jabones, es la reacción inversa a la esterificación.
Los ésteres se hidrogenan más fácilmente que los ácidos, empleándose generalmente el éster etílico tratado con una mezcla de sodio y alcohol (Reducción de Bouveault-Blanc). El hidruro de litio y aluminio reduce ésteres de ácidos carboxílicos para dar 2 equivalentes de alcohol.[2] La reacción es de amplio espectro y se ha utilizado para reducir diversos ésteres. Las lactonas producen dioles. Existen diversos agentes reductores alternativos al hidruro de litio y aluminio como el DIBALH, el trietil-borohidruro de litio o BH3–SiMe3 a reflujo con THF.[3]
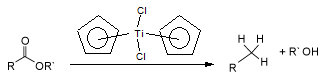
El dicloruro de titanoceno reduce los ésteres de ácidos carboxílicos hasta el alcano (RCH3)y el alcohol R-OH.[4] El mecanismo probablemente se debe a la formación de un alqueno intermediario.
El hidrógeno α de muchos ésteres puede ser sustraído con una base no nucleofílica o el alcóxido correspondiente al éster. El carbanión generado puede unirse a diversos sustratos en diversas reacciones de condensación, tales como la condensación de Claisen, la condensación de Dieckmann y la síntesis malónica. Muchos métodos de síntesis de anillos heterocíclicos aprovechan estas propiedades químicas de los ésteres, tales como la síntesis de pirroles de Hantzsch y la síntesis de Feist-Benary.
Existen reacciones de condensación en las que se utiliza un reductor que aporte electrones para formar el enlace C-C entre grupos acilo, como el caso de la condensación aciloínica. Los ésteres pueden dar alcoholes con dos sustituyentes idénticos por adición de reactivos de Grignard. Unas aplicación de esta reacción es la reacción de Fujimoto-Belleau.
Referencias
↑ Nomenclatura de ésteres.
↑ Gaylord, N.G. Reduction with Complex Metal Hydrides, Wiley, NY, 1956,pp. 391–531
↑ Ayers, T.A. Tetrahedron Lett. 1999, 40, 5467
↑ van Tamelen, E.E.; Gladys, J.A. J. Am. Chem. Soc. 1974, 96, 5290.
