Ácido carboxílico

Estructura de un ácido carboxílico, donde R es un hidrógeno o una cadena carbonada.
Los ácidos carboxílicos constituyen un grupo de compuestos, caracterizados porque poseen un grupo funcional llamado grupo carboxilo o grupo carboxi (–COOH). En el grupo funcional carboxilo coinciden sobre el mismo carbono un grupo hidroxilo (-OH) y carbonilo (-C=O). Se puede representar como -COOH o -CO2H.
Índice
1 Características y propiedades
2 Síntesis
2.1 Vías industriales
2.2 Métodos de laboratorio
2.3 Reacciones menos comunes
3 Reacciones
4 Nomenclatura
4.1 Ejemplo de ácidos carboxílico complejo
4.2 Otros ácidos carboxílicos importantes
5 Referencias
6 Enlaces externos
Características y propiedades
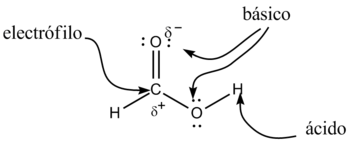
Comportamiento químico de las diferentes posiciones del grupo carboxilo
Los ácidos carboxílicos tienen como fórmula general R-COOH. Tienen propiedades ácidas; los dos átomos de oxígeno son electronegativos y tienden a atraer a los electrones del átomo de hidrógeno del grupo hidroxilo con lo que se debilita el enlace, produciéndose en ciertas condiciones una ruptura heterolítica, cediendo el correspondiente protón o hidrón, H+, y quedando el resto de la molécula con carga -1 debido al electrón que ha perdido el átomo de hidrógeno, por lo que la molécula queda como R-COO-.
R−COOH⇌R−COO−+H+{displaystyle R-COOHrightleftharpoons R-COO^{-}+H^{+}}

Además, en este anión, la carga negativa se distribuye (se deslocaliza) simétricamente entre los dos átomos de oxígeno, de forma que los enlaces carbono-oxígeno adquieren un carácter de enlace parcialmente doble.
Estos no solo son importantes y esenciales por su propia naturaleza, sino que además son la materia primas al momento de preparar los derivados de acilo, tales como : los cloruros de ácido, los ésteres,las amidas, y los tioésteres. Sin contar que en la mayoría de las rutas biológicas están presentes.
Generalmente los ácidos carboxílicos son ácidos débiles, con sólo un 1 % de sus moléculas disociadas para dar los correspondientes iones, a temperatura ambiente y en disolución acuosa.
Pero sí son más ácidos que otros, en los que no se produce esa deslocalización electrónica, como por ejemplo los alcoholes. Esto se debe a que la estabilización por resonancia o deslocalización electrónica, provoca que la base conjugada del ácido sea más estable que la base conjugada del alcohol y por lo tanto, la concentración de protones provenientes de la disociación del ácido carboxílico sea mayor a la concentración de aquellos protones provenientes del alcohol; hecho que se verifica experimentalmente por sus valores relativos menores de pKa. El ion resultante, R-COO-, se nombra con el sufijo "-ato".

El grupo carboxilo actuando como ácido genera un ion carboxilato que se estabiliza por resonancia
Por ejemplo, el anión procedente del ácido acético se llama ion acetato. Al grupo RCOO- se le denomina carboxilato.

Disociación del ácido acético, sólo se muestran las dos estructuras en resonancia que más contribuyen a la estructura real
Síntesis
Vías industriales
Las síntesis industriales de los ácidos carboxílicos difieren generalmente de las usadas a pequeña escala (en el laboratorio) porque requieren equipamiento especializado.
Oxidación de aldehídos con aire, utilizando catalizadores de cobalto y manganeso. Los aldehídos necesarios son obtenidos fácilmente a partir de alquenos por hidroformilación.- Oxidación de hidrocarburos usando aire. Para los alcanos más simples, el método no es selectivo. Los compuestos alílicos y bencílicos sufren oxidaciones más selectivas. Los grupos alquilo en un anillo bencénico se oxidan hasta el grupo carboxilo (-COOH), sin importar la longitud previa de la cadena. La formación de ácido benzoico a partir del tolueno, de ácido tereftálico a partir del p-xileno, y de ácido ftálico a partir del o-xileno, son algunas conversiones ilustrativas a gran escala. El ácido acrílico se genera a partir del propeno.[1]
Deshidrogenación de alcoholes, catalizada por bases.- La carbonilación es el método más versátil cuando va acompañado a la adición de agua. Este método es efectivo para alquenos que generan carbocationes secundarios y terciarios, por ejemplo, de isobutileno a ácido piválico. En la reacción de Koch, la adición de agua y monóxido de carbono (CO) a alquenos está catalizada por ácidos fuertes. El ácido acético y el ácido fórmico son producidos por la carbonilación del metanol, llevada a cabo con yodo y alcóxido, quienes actúan como promotores, y frecuentemente con altas presiones de monóxido de carbono, generalmente involucrando varios pasos hidrolíticos adicionales, en el proceso Monsanto y el proceso Cativa. Las hidrocarboxilaciones involucran la adición simultánea de agua y CO. Tales reacciones son llamadas algunas veces como "Química de Reppe":
- HCCH + CO + H2O → CH2=CHCO2H
- Algunos ácidos carboxílicos de cadena larga son obtenidos por la hidrólisis de los triglicéridos obtenidos de aceites y grasas de plantas y animales. Estos métodos están relacionados con la elaboración del jabón.
Métodos de laboratorio
Los métodos de preparación para reacciones a pequeña escala con fines de investigación, instrucción, o producción de pequeñas cantidades de productos químicos suelen utilizar reactivos caros.
- Oxidación de alcoholes primarios con agentes oxidantes fuertes como el dicromato de potasio, el reactivo de Jones, el permanganato de potasio, o el clorito de sodio. El método es adecuado en condiciones de laboratorio, comparado con el uso industrial del aire, pero este último es más ecológico, puesto que conduce a menos subproductos inorgánicos, tales como óxidos de cromo o manganeso.
- Ruptura oxidativa de olefinas, por ozonólisis, permanganato de potasio, o dicromato de potasio.
- Los ácidos carboxílicos también pueden obtenerse por la hidrólisis de los nitrilos, ésteres, o amidas, generalmente con catálisis ácida o básica.
Carbonilación de un reactivo de organolitio o Grignard:
- RLi + CO2 → RCO2Li
- RCO2Li + HCl → RCO2H + LiCl
Halogenación de metilcetonas, seguida de hidrólisis en la reacción del haloformo
- La reacción de Kolbe-Schmitt, que provee una ruta de síntesis al ácido salicílico, precursor de la aspirina
Reacciones menos comunes
Muchas reacciones conducen a ácidos carboxílicos, pero son usadas sólo en casos muy específicos, o principalmente son de interés académico:
Dismutación de un aldehído en la reacción de Cannizzaro.- Transposición de dicetonas, en la Transposición del ácido bencílico, involucrando la generación de ácidos benzoicos en la reacción de von Richter, a partir de nitrobencenos, y en la reacción de Kolbe-Schmitt, a partir de fenoles.
Reacciones
Obtención de sales de ácidos carboxílicos y amidas a partir del ácido:
- Los ácidos carboxílicos reaccionan con bases para formar sales. En estas sales el hidrógeno del grupo -OH se reemplaza con el ion de un metal, por ejemplo Na+. De esta forma, el ácido acético reacciona con hidrogenocarbonato de sodio para dar acetato de sodio, dióxido de carbono y agua.
CH3COOH+NaHCO3→CH3COO−Na++CO2+H2O{displaystyle CH_{3}COOH+NaHCO_{3}rightarrow CH_{3}COO^{-}Na^{+}+CO_{2}+H_{2}O}

Entonces, luego de haber obtenido la sal, podemos calentar la misma para llegar a la amida mediante deshidratación.[2] La reacción general y su mecanismo son los siguientes:
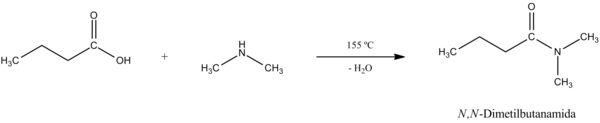
Reacción general.

Mecanismo de reacción.
- Esterificaciones

Esquema general de las esterificaciones.
- Formación de derivados de deshidratación, como anhídridos y cetenas.
Halogenación en la posición alfa: Llamada halogenación de Hell-Volhard-Zelinsky o también conocida como Reacción de Hell-Volhard-Zelinsky. La misma sustituye un átomo de hidrógeno en la posición alfa con un halógeno, reacción que presenta utilidad sintética debido a la introducción de buenos grupos salientes en la posición alfa.

Resumen de la halogenación de Hell-Volhard-Zelinsky
Los grupos carboxilos reaccionan con los grupos amino para formar amidas. En el caso de aminoácidos que reaccionan con otros aminoácidos para dar proteínas, al enlace de tipo amida que se forma se denomina enlace peptídico. Igualmente, los ácidos carboxílicos pueden reaccionar con alcoholes para dar ésteres, o bien con halogenuros para dar halogenuros de ácido, o entre sí para dar anhídridos. Los ésteres, anhídridos, halogenuros de ácido y amidas se llaman derivados de ácido.
- La reacción de Varrentrapp tiene pocas aplicaciones en síntesis, pero es útil en la determinación de ciertos ácidos grasos. Consiste en la descomposición de ácidos grasos insaturados en otros de cadena más corta con desprendimiento de hidrógeno.
- En la reacción de Arndt-Eistert se inserta un metileno α a un ácido carboxílico.
- Descarboxilación de Barton
- Reacción de Hunsdiecker
- Reacción de Kochi
- Descarboxilación de Krapcho
- Electrólisis de Kolbe
Nomenclatura
Los ácidos carboxílicos se nombran con la ayuda de la terminación –oico o –ico que se une al nombre del hidrocarburo de referencia y anteponiendo la palabra ácido:
Ejemplo
CH3-CH2-CH3 propano
CH3-CH2-COOH Ácido propanoico (propan + oico)
Los nombres triviales de los ácidos carboxílicos se designan según la fuente natural de la que inicialmente se aislaron. Se clasificaron así:
| Nombre trivial | Nombre IUPAC | Estructura |
|---|---|---|
Ácido fórmico | Ácido metanoico | HCOOH |
Ácido acético | Ácido etanoico | CH3COOH |
Ácido propiónico | Ácido propanoico | CH3CH2COOH |
Ácido butírico | Ácido butanoico | CH3(CH2)2COOH |
Ácido valérico | Ácido pentanoico | CH3(CH2)3COOH |
Ácido caproico | Ácido hexanoico | CH3(CH2)4COOH |
| Ácido enántico | Ácido heptanoico | CH3(CH2)5COOH |
Ácido caprílico | Ácido octanoico | CH3(CH2)6COOH |
| Ácido pelargónico | Ácido nonanoico | CH3(CH2)7COOH |
Ácido cáprico | Ácido decanoico | CH3(CH2)8COOH |
| Ácido undecílico | Ácido undecanoico | CH3(CH2)9COOH |
Ácido láurico | Ácido dodecanoico | CH3(CH2)10COOH |
| - | Ácido tridecanoico | CH3(CH2)11COOH |
Ácido mirístico | Ácido tetradecanoico | CH3(CH2)12COOH |
| - | Ácido pentadecanoico | CH3(CH2)13COOH |
Ácido palmítico | Ácido hexadecanoico | CH3(CH2)14COOH |
| Ácido margárico | Ácido heptadecanoico | CH3(CH2)15COOH |
Ácido esteárico | Ácido octadecanoico | CH3(CH2)16COOH |
| - | Ácido nonadecanoico | CH3(CH2)17COOH |
Ácido araquídico | Ácido eicosanoico | CH3(CH2)18COOH |
| - | Ácido heneicosanoico | CH3(CH2)19COOH |
Ácido behénico | Ácido docosanoico | CH3(CH2)20COOH |
| - | Ácido tricosanoico | CH3(CH2)21COOH |
Ácido lignocérico | Ácido tetracosanoico | CH3(CH2)22COOH |
Ácido pentacosanoico | CH3(CH2)23COOH | |
Ácido cerótico | Ácido hexacosanoico | CH3(CH2)24COOH |
| - | Ácido heptacosanoico | CH3(CH2)25COOH |
Ácido montánico | Ácido octacosanoico | CH3(CH2)26COOH |
| - | Ácido nonacosanoico | CH3(CH2)27COOH |
Ácido melísico | Ácido triacontanoico | CH3(CH2)28COOH |
| - | Ácido henatriacontanoico | CH3(CH2)29COOH |
Ácido laceroico | Ácido dotriacontanoico | CH3(CH2)30COOH |
Ácido psílico | Ácido tritriacontanoico | CH3(CH2)31COOH |
Ácido gédico | Ácido tetratriacontanoico | CH3(CH2)32COOH |
Ácido ceroplástico | Ácido pentatriacontanoico | CH3(CH2)33COOH |
| - | Ácido hexatriacontanoico | CH3(CH2)34COOH |
| Nombre común | Nombre IUPAC | Fórmula química | Fórmula estructural |
|---|---|---|---|
Ácido oxálico | ácido etanodioico | HOOC-COOH | |
Ácido malónico | ácido propanodioico | HOOC-(CH2)-COOH | |
Ácido succínico | ácido butanodioico | HOOC-(CH2)2-COOH | 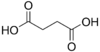 |
Ácido glutárico | ácido pentanodioico | HOOC-(CH2)3-COOH | |
Ácido adípico | Ácido hexanodioico | HOOC-(CH2)4-COOH |  |
Ácido pimélico | ácido heptanodioico | HOOC-(CH2)5-COOH | |
Ácido subérico | ácido octanodioico | HOOC-(CH2)6-COOH |  |
Ácido azelaico | ácido nonadioico | HOOC-(CH2)7-COOH | |
Ácido sebácico | ácido decadioico | HOOC-(CH2)8-COOH |  |
Ácido maleico | Ácido cis-butenodioico | HOOC-CH=CH-COOH | 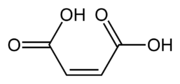 |
Ácido fumárico | Ácido trans-butenodioico | HOOC-CH=CH-COOH | 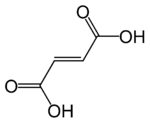 |
Ácido ftálico | ácido beceno-1,2-dicarboxílico o-ácido ftálico | C6H4(COOH)2 |  |
Ácido isoftálico | ácido beceno-1,3-dicarboxílico m-ácido ftálico | C6H4(COOH)2 |  |
Ácido tereftálico | ácido beceno-1,4-dicarboxílico p-ácido ftálico | C6H4(COOH)2 | 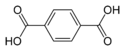 |
Ácido truxílico | ácido 2,4-difenilciclobutan-1,3-dicarboxílico | (C6H5)2C4H4(COOH)2 |  |
Ácido truxínico | ácido 3,4-difenilciclobutan-1,2-dicarboxílico | (C6H5)2C4H4(COOH)2 |  |
| Nombre trivial | Estructura química | Δx | C:D | n−x |
|---|---|---|---|---|
| Ácido acrílico | CH2=CH-COOH | - | 3:1 | n−1 |
| Ácido crotónico | CH3CH=CH-COOH | trans-Δ2 | 4:1 | n−2 |
| Ácido isocrotónico | CH3CH=CH-COOH | cis-Δ2 | 4:1 | n−2 |
| Ácido sórbico | CH3CH=CH-CH=CH-COOH | trans,trans-Δ2,Δ4 | 6:2 | n−2 |
| Ácido undecilénico | CH2=CH(CH2)8COOH | - | 11:1 | n−1 |
| Ácido palmitoleico | CH3(CH2)5CH=CH(CH2)7COOH | cis-Δ9 | 16:1 | n−7 |
| Ácido sapiénico | CH3(CH2)8CH=CH(CH2)4COOH | cis-Δ6 | 16:1 | n−10 |
| Ácido oleico | CH3(CH2)7CH=CH(CH2)7COOH | cis-Δ9 | 18:1 | n−9 |
| Ácido eláidico | CH3(CH2)7CH=CH(CH2)7COOH | trans-Δ9 | 18:1 | n−9 |
| Ácido vaccénico | CH3(CH2)5CH=CH(CH2)9COOH | trans-Δ11 | 18:1 | n−7 |
| Ácido linoleico | CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH | cis,cis-Δ9,Δ12 | 18:2 | n−6 |
| Ácido linoeláidico | CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH | trans,trans-Δ9,Δ12 | 18:2 | n−6 |
| Ácido α-Linolénico | CH3CH2CH=CHCH2CH=CHCH2CH=CH(CH2)7COOH | cis,cis,cis-Δ9,Δ12,Δ15 | 18:3 | n−3 |
| Ácido ɣ-Linolénico | CH3(CH2)4CH=CHCH2CH=CHCH2CH=CH(CH2)4COOH | cis,cis,cis-Δ6,Δ9,Δ12 | 18:3 | n−6 |
| Ácido punícico | CH3(CH2)3CH=CH-CH=CH-CH=CH(CH2)7COOH | cis,trans,cis-Δ9,Δ11,Δ13 | 18:3 | n−5 |
| Ácido araquidónico | CH3(CH2)4CH=CHCH2CH=CHCH2CH=CHCH2CH=CH(CH2)3COOHNIST | cis,cis,cis,cis-Δ5Δ8,Δ11,Δ14 | 20:4 | n−6 |
| Ácido eicosapentaenoico | CH3CH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CH(CH2)3COOH | cis,cis,cis,cis,cis-Δ5,Δ8,Δ11,Δ14,Δ17 | 20:5 | n−3 |
| Ácido erúcico | CH3(CH2)7CH=CH(CH2)11COOH | cis-Δ13 | 22:1 | n−9 |
| Ácido docosahexaenoico | CH3CH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CH(CH2)2COOH | cis,cis,cis,cis,cis,cis-Δ4,Δ7,Δ10,Δ13,Δ16,Δ19 | 22:6 | n−3 |
En el sistema IUPAC los nombres de los ácidos carboxílicos se forman reemplazando la terminación “o” de los alcanos por “oico”, y anteponiendo la palabra ácido.
El esqueleto de los ácidos alcanoicos se enumera asignando el N° 1 al carbono carboxílico y continuando por la cadena más larga que incluya el grupo COOH.
Ejemplo de ácidos carboxílico complejo
HOCH3-CH3-CH=CH-CH(CH3-CH=CH3)-CHBr-COOH
En este compuesto aparte del grupo funcional COOH, hay una función alcohol, pero de acuerdo a su importancia y relevancia el grupo COOH es el principal; por lo tanto el grupo alcohol se lo nombra como sustituyente. Por lo tanto el nombre de este compuesto es: Ácido 3-alil-2-bromo-7-hidroxi-4-heptenoico.
La palabra carboxi también se utiliza para nombrar al grupo COOH cuando en la molécula hay otro grupo funcional que tiene prioridad sobre él.
Para mayores detalles, consulte Nomenclatura de ácidos carboxílicos
Otros ácidos carboxílicos importantes
- Ácido benzoico
- Ácido láctico
- Ácido tartárico
- Ácido salicílico
- Ácido cafeico
- Ácido cinámico
- Ácido cítrico
- Todos los aminoácidos contienen un grupo carboxilo y un grupo amino. Cuando reacciona el grupo carboxilo de un aminoácido con el grupo amino de otro se forma un enlace amida llamado enlace peptídico. Las proteínas son polímeros de aminoácidos y tienen en un extremo un grupo carboxilo terminal.
- Todos los ácidos grasos son ácidos carboxílicos. Por ejemplo, el ácido palmítico, esteárico, oleico, linoleico, etcétera. Estos ácidos con la glicerina forman ésteres llamados triglicéridos.

Ácido palmítico o ácido hexadecanoico, se representa con la fórmula CH3(CH2)14COOH
- Las sales de ácidos carboxílicos de cadena larga se emplean como tensoactivos.
Referencias
↑ Wilhelm Riemenschneider “Carboxylic Acids, Aliphatic” in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. doi 10.1002/14356007.a05_235 10.1002/14356007.a05_235.
↑ Vollhardt, K. Peter. Química Orgánica. 3.ª edición. Año 2000. Omega. Madrid. pp. 849-850. ISBN 84-282-1172-8.
Enlaces externos
Los ácidos carboxílicos, resumen de la Universidad Autónoma del Estado de Hidalgo.
