Capa de ozono

Esquema de la distribución de ozono en la atmósfera. El pico superior corresponde a lo que llamamos capa de ozono.
Se denomina capa de ozono u ozonosfera a la zona de la estratosfera terrestre que contiene una concentración relativamente alta[1] de ozono. Esta capa, que se extiende aproximadamente de los 15 km a los 50 km de altitud, reúne el 90 % del ozono presente en la atmósfera y absorbe del 97 al 99 % de la radiación ultravioleta de baja frecuencia (150-300 nm).
La capa de ozono fue descubierta en 1913 por los físicos franceses Charles Fabry y Henri Buisson. Sus propiedades fueron examinadas en detalle por el meteorólogo británico G.M.B. Dobson, quien desarrolló un sencillo espectrofotómetro que podía ser usado para medir el ozono estratosférico desde la superficie terrestre. Entre 1928 y 1958 Dobson estableció una red mundial de estaciones de monitoreo de ozono, las cuales continúan operando en la actualidad. La unidad Dobson, una unidad de medición de la cantidad de ozono, fue nombrada en su honor.
Índice
1 Origen de la capa de ozono
2 El equilibrio dinámico del ozono
3 Problemas en la capa de ozono
3.1 Esperanzas de solución
4 Véase también
5 Notas
6 Enlaces externos
Origen de la capa de ozono
El ozono es la forma alotrópica del oxígeno, que sólo está estable en determinadas condiciones de presión y temperatura. Es un gas compuesto por tres átomos de oxígeno (O3{displaystyle O_{3}}
Los mecanismos fotoquímicos que se producen en la capa de ozono fueron investigados por el físico británico Sydney Chapman en 1930. La formación del ozono de la estratosfera terrestre es catalizada por los fotones de luz ultravioleta que al interaccionar con las moléculas de oxígeno gaseoso, que están constituidas por dos átomos de oxígeno (O2{displaystyle O_{2}}


La concentración de ozono es mayor entre los 15 y 40 km, con un valor de 2-8 partículas por millón, en la zona conocida como capa de ozono. Si todo ese ozono fuese comprimido a la presión del aire al nivel del mar, esta capa tendría solo 3 milímetros de espesor.
El ozono actúa como filtro, o escudo protector, de las radiaciones nocivas, y de alta energía, que llegan a la Tierra, permitiendo que pasen otras como la ultravioleta de onda larga, que de esta forma llega a la superficie. Esta radiación ultravioleta es la que permite la vida en el planeta, ya que es la que permite que se realice la fotosíntesis del reino vegetal, que se encuentra en la base de la pirámide trófica.
Al margen de la capa de ozono, el 10 % de ozono restante está contenido en la troposfera, y es peligroso para los seres vivos por su fuerte carácter oxidante. Elevadas concentraciones de este compuesto a nivel superficial forman el denominado esmog fotoquímico. El origen de este ozono se explica en un 10 % como procedente de ozono transportado desde la estratosfera y el resto es creado a partir de diversos mecanismos, como el producido por las tormentas eléctricas que ionizan el aire y lo hacen, muy brevemente, buen conductor de la electricidad. Pueden verse algunas veces dos relámpagos consecutivos que siguen aproximadamente la misma trayectoria.
El equilibrio dinámico del ozono
El ozono se produce mediante la siguiente reacción:
O2+hν→O+O{displaystyle O_{2}+hnu rightarrow O+O}[2]
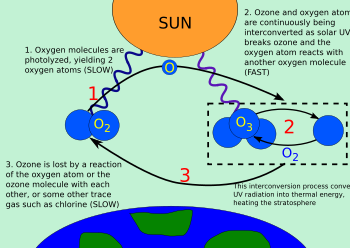
Ciclo del ozono.
- O+O2→O3{displaystyle O+O_{2}rightarrow O_{3}}
- O+O2→O3{displaystyle O+O_{2}rightarrow O_{3}}
Es decir, el oxígeno molecular que se encuentra en las capas altas de la atmósfera es bombardeado por la radiación solar. Del amplio espectro de radiación incidente una determinada fracción de fotones cumple los requisitos energéticos necesarios para catalizar la rotura del doble enlace de los átomos de oxígeno de la molécula de oxígeno molecular.
Posteriormente, el Sol convierte una molécula de ozono en una de oxígeno diatómico y un átomo de oxígeno sin enlazar:
- O3+hν→O2+O{displaystyle O_{3}+hnu rightarrow O_{2}+O}
- O3+hν→O2+O{displaystyle O_{3}+hnu rightarrow O_{2}+O}
Durante la fase oscura (la noche de una determinada región del planeta), el oxígeno monoatómico, que es altamente reactivo, se combina con el ozono de la ozonosfera para formar una molécula de oxígeno biatómico:
- O3+O→2O2{displaystyle O_{3}+Orightarrow 2O_{2}}
- O3+O→2O2{displaystyle O_{3}+Orightarrow 2O_{2}}
Para mantener constante la capa de ozono en la estratosfera esta reacción fotoquímica debe suceder en perfecto equilibrio, pero estas reacciones son fácilmente perturbables por moléculas, como los compuestos clorados (como los clorofluorocarbonos[3]) y los compuestos bromurados.
Problemas en la capa de ozono

Promedio mensual Global de O3{displaystyle O_{3}}
 .
.
Comparación del agujero en la capa de ozono sobre la Antártida en 1979 y 2008. La densidad de ozono llegó a su mínimo en el año 2000 y a partir de entonces se ha ido recuperando. Se espera que en pocas décadas vuelva a sus niveles originales.
El seguimiento observacional de la capa de ozono, llevado a cabo en los últimos años, ha llegado a la conclusión de que dicha capa puede considerarse seriamente amenazada. Este es el motivo principal por el que se reunió la Asamblea General de las Naciones Unidas el 16 de septiembre de 1987, firmando el Protocolo de Montreal. En 1994, la Asamblea General de las Naciones Unidas proclamó el día 16 de septiembre como el Día Internacional para la Preservación de la Capa de Ozono.[4]
El desgaste grave de la capa de ozono provocará el aumento de los casos de melanomas, cáncer de piel, cataratas oculares, supresión del sistema inmunitario en humanos y en otras especies. También afectará a los cultivos sensibles a la radiación ultravioleta.
Para preservar la capa de ozono hay que disminuir a cero el uso de compuestos químicos como los clorofluorocarbonos (refrigerantes industriales, propelentes), y fungicidas de suelo (como el bromuro de metilo) (Argentina, 900 toneladas/año[5]) que destruyen la capa de ozono a un ritmo 50 veces superior a los CFC.
Esperanzas de solución
Las últimas mediciones realizadas con satélites indican que el agujero en la capa de ozono se está reduciendo, a la vez que los niveles de clorofluorocarbonos (CFC) han disminuido.[6] Esos compuestos químicos dañan la capa de ozono de la atmósfera que protege nuestro planeta. Durante más de cincuenta años, el número de CFC presentes en la parte alta de la atmósfera ha aumentado a un ritmo constante hasta el año 2000.[7] Desde entonces, la concentración de CFC se ha reducido a razón de casi un 1 % anual.[8] El descenso permite esperar que el agujero de la capa de ozono pueda cerrarse a mediados de siglo.[6] No obstante, estos productos todavía causan daño. A pesar del descenso, el agujero de la Antártida en el año 2005 había alcanzado una extensión de casi 29 000 000 km² (kilómetros cuadrados), más de tres veces el tamaño de Australia.[8]
Véase también
- Agujero de ozono
- CFC
- Día Internacional para la Preservación de la Capa de Ozono
- Mario J. Molina
- Potencial de agotamiento del ozono
Notas
↑ Se estima que la concentración de ozono en la ozonosfera es de algunas partículas por millón. Dicha concentración puede parecer muy pequeña en términos absolutos, sin embargo, en términos relativos es mucho más alta que las concentraciones que se presentan en la atmósfera baja, aunque bastante pequeña comparada con la concentración de los principales componentes de la atmósfera.
↑ hν{displaystyle hnu }es la energía del fotón que inicia la reacción
↑ Los más comunes son CFCl3{displaystyle CFCl_{3}}(freón 11), CF2Cl2{displaystyle CF_{2}Cl_{2}}
(freón 12), C2F3Cl3{displaystyle C_{2}F_{3}Cl_{3}}
(freón 113) y C2F4Cl4{displaystyle C_{2}F_{4}Cl_{4}}
(freón 114).
↑ Resolución 49/114 de la Asamblea General de las Naciones Unidas designando el 16 de septiembre como Día Internacional para la Preservación de la Capa de Ozono
↑ INTA Balcarce - Sobre el bromuro de metilo y su eliminación (enlace roto disponible en Internet Archive; véase el historial y la última versión).
↑ ab «First Direct Proof of Ozone Hole Recovery Due to Chemicals Ban» [Primeras pruebas directas de la recuperación de agujero de ozono debido a las prohibiciones químicas.]. https://www.nasa.gov/ (en inglés). 4 de enero de 2018. Consultado el 13 de abril de 2018.
↑ «Is the ozone layer on the road to recovery?» [¿Está la capa de ozono en camino de recuperarse?]. http://www.esa.int/ESA (en inglés). 8 de febrero de 2013. Consultado el 13 de abril de 2018.
↑ ab Andrew Klekociuk, Paul Krummel (15 de septiembre de 2017). «After 30 years of the Montreal Protocol, the ozone layer is gradually healing» [Pasados 30 años desde el Protocolo de Montreal, la capa de ozono se recupera gradualmente.]. https://blog.csiro.au/ (en inglés). Consultado el 13 de abril de 2018.
Enlaces externos
 Wikiquote alberga frases célebres de o sobre Capa de ozono.
Wikiquote alberga frases célebres de o sobre Capa de ozono.
 Wikimedia Commons alberga una categoría multimedia sobre Capa de ozono.
Wikimedia Commons alberga una categoría multimedia sobre Capa de ozono.- Tecnozono: información acerca de la capa de ozono.



